题目内容
13.常温下,四个容积为V L的容积中分别装有质量相同的下列气体,产生的压强最大的是( )| A. | Cl2 | B. | HCl | C. | SO2 | D. | CO2 |
分析 相同温度下,质量、体积相同的不同气体,其压强与物质的量成正比,如果产生的压强最大,则气体的物质的量最大即可,根据n=$\frac{m}{M}$计算.
解答 解:相同温度下,质量、体积相同的不同气体,其压强与物质的量成正比,如果产生的压强最大,则气体的物质的量最大即可,根据n=$\frac{m}{M}$知,相同质量时n、M成正比,n最大时M最小,Cl2、HCl、SO2、CO2的摩尔质量分别是71g/mol、36.5g/mol、64g/mol、44g/mol,摩尔质量最小的是HCl,所以压强最大的是HCl,
故选B.
点评 本题考查阿伏伽德罗定律及其推论,侧重考查分析能力,明确物质的量公式中各个物理量之间的关系式是解本题关键,根据PV=nRT=$\frac{m}{M}$RT判断即可,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.某种药物合成中间体的结构简式为有关该物质的说法不正确的是 ( )


| A. | 属于芳香烃 | |
| B. | 能发生消去反应和酯化反应 | |
| C. | 分子中所有碳原子不可能在同一平面内 | |
| D. | 1mol该有机物与足量NaOH溶液反应,消耗5molNaOH |
4.下列有关化学用语表示正确的是( )
| A. | 硫化钠的电子式: | |
| B. | 氯原子的结构示意图: | |
| C. | 氢氧根离子的电子式: | |
| D. | 质量数为146、中子数为54的铀(U)原子:${\;}_{54}^{146}$U |
1.已知氨水的密度小于1g/cm3,现将质量分数为15%的氨水与水等体积混合后所得稀氨水的质量分数为( )
| A. | 7.5% | B. | 大于7.5%. | C. | 小于7.5% | D. | 无法确定 |
8.分别将下列各组物质同时加到水中,得到无色、透明溶液的是( )
| A. | HNO3、NaCl、K2SO4 | B. | KCl、NaOH、CuSO4 | ||
| C. | BaCl2、NaOH、H2SO4 | D. | FeCl3、Na2SO4、KCl |
18.研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)已知石墨的标准燃烧热为y kJ•mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量,则石墨与氧气反应生成CO的热化学方程式为C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-(20x-y)kJ•mol-1.
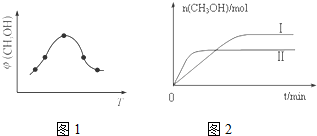
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=$\frac{C(CH{\;}_{3}OH)C(H{\;}_{2}O)}{C(CO{\;}_{2})C{\;}^{3}(H{\;}_{2})}$.
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H<(填“>”“<”或“=”)0.
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”“<”或“=”).
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为0.4<n(c)≤1mol.
(1)已知石墨的标准燃烧热为y kJ•mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量,则石墨与氧气反应生成CO的热化学方程式为C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-(20x-y)kJ•mol-1.

(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=$\frac{C(CH{\;}_{3}OH)C(H{\;}_{2}O)}{C(CO{\;}_{2})C{\;}^{3}(H{\;}_{2})}$.
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H<(填“>”“<”或“=”)0.
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”“<”或“=”).
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
5.已知下面表格中的数据,
根据上述表格中的数据,推断下列反应为吸热反应的是( )
①2H2O(g)═2H2(g)+O2(g)②H2(g)+Cl2(g)═2HCl(g)③H2(g)+Br2(g)═2HBr(g)④2HI(g)═H2(g)+I2(g)
| 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
①2H2O(g)═2H2(g)+O2(g)②H2(g)+Cl2(g)═2HCl(g)③H2(g)+Br2(g)═2HBr(g)④2HI(g)═H2(g)+I2(g)
| A. | ①④ | B. | ②③ | C. | 只有① | D. | 只有④ |
2.下列各组物质中,互为同素异形体的是( )
| A. | 甲烷和乙烷 | B. | 丙烯和环丙烷 | C. | 金刚石和石墨 | D. | 35Cl 和37Cl |
