题目内容
1.已知氨水的密度小于1g/cm3,现将质量分数为15%的氨水与水等体积混合后所得稀氨水的质量分数为( )| A. | 7.5% | B. | 大于7.5%. | C. | 小于7.5% | D. | 无法确定 |
分析 加水稀释时稀释前后溶液中溶质的质量不变,该氨水用等体积的水稀释后,所得氨水的质量为原氨水质量与所加水质量和,所得氨水溶液中溶质为15%的氨水中溶质,利用溶液的溶质质量分数计算式求出所得氨水的质量分数;其中需要使用m=ρV对体积进行换算.
解答 解:设加水的体积为V,则15%的氨水体积也为V,设氨水密度为ρg/cm3(ρ<1),水的密度为1g/cm3,
该氨水用等体积的水稀释后,所得氨水的质量分数=$\frac{V×ρg/c{m}^{3}×15%}{V×ρg/c{m}^{3}+V×1g/c{m}^{3}}$×100%=$\frac{ρ}{ρ+1}$×15%<7.5%;
故选C.
点评 本题考查了有关溶质质量分数的简单计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意密度对溶液体积和质量分数的影响.

练习册系列答案
相关题目
11. T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
 T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2 mol/(L•min) | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应放热反应 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 曲线Ⅱ对应的条件改变是加入催化剂 |
12.对如图两种化合物的结构或性质描述正确的是( )
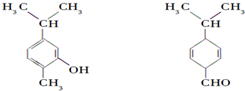
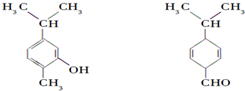
| A. | 不是同分异构体 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 均能与H2在一定条件下发生加成反应 | |
| D. | 可用红外光谱区分,但不能用核磁共振氢谱区分 |
13.常温下,四个容积为V L的容积中分别装有质量相同的下列气体,产生的压强最大的是( )
| A. | Cl2 | B. | HCl | C. | SO2 | D. | CO2 |
6.碳酸镍可用于电镀、陶瓷器着色等.镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS(含有Fe、Cu、Ca、Mg、Zn等元素杂质),从镍矿渣出发制备碳酸镍的流程如下:
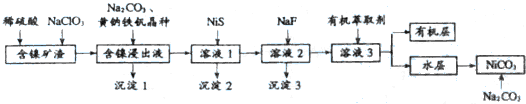
已知:(Ⅰ)含镍浸出液的成分及离子沉淀的pH:
(Ⅱ)溶度积常数:
(1)镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS,写出浸取时反应的离子方程式3NiS+4ClO3-=3Ni2++3SO42-+4Cl-或3NiS+ClO3-+6H+=3Ni2++3S+Cl-+3H2O.
(2)黄钠铁钒[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速度快,容易过滤等特点,常用于除铁.写出流程中第一次加入 Na2CO3溶液时反应的离子方程式:Na++3Fe3++2SO42-+3H2O+3CO32-=NaFe3(SO4)2(OH)6↓+3CO2↑;
(3)NiS的作用是除去溶液中的Cu2+,原理是NiS+Cu2+═CuS+Ni2+,该反应的平衡常数是8.43×104;
(4)滤液2中加入NaF的作用是除去溶液中的Ca2+、Mg2+,则加入NaF先沉淀的离子是Mg2+.
(5)NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由NiCO3为原料获得,结合上述流程,制备NiSO4•6H2O的操作步骤如下:
①向被有机萃取剂萃取后所得的水层中加入足量Na2CO3溶液(流程中第二次加Na2CO3溶液),搅拌,得NiCO3沉淀:
②过滤,并用蒸馏水洗涤沉淀2-3次直至流出液用pH试纸检验呈中性;
③向沉淀中加6mol/L的H2SO4溶液,直至恰好完全溶解;
④蒸发、冷却结晶并从溶液中分离出晶体;
⑤用少量乙醇洗涤并晾干.
确定步骤①中Na2CO3溶液足量,碳酸镍己完全沉淀的简单方法是:上层清液呈无色(或静置后向上层液中再加入Na2CO3溶液后没有沉淀生成);
补充完整上述步骤②和③【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】.

已知:(Ⅰ)含镍浸出液的成分及离子沉淀的pH:
| 元素 | Na2+ | Fe3+ | Cu2+ | Ca2+ | Mg2+ | Zn2- |
| 浓度/g•L-1 | 5.25 | 0.47 | 0.30 | 0.40 | 0.18 | 0.81 |
| 开始沉淀PH | 6.4 | 2.2 | 4.7 | / | 9.6 | 6.5 |
| 完全沉淀PH | 8.4 | 3.5 | 6.7 | / | 11.6 | 8.5 |
| 难溶物 | NiS | CuS | ZnS | |
| 溶度积常数 | 1.07×10-21 | 1.27×10-26 | 2.93×10-25 | |
| 难溶物 | CaF2 | MgF2 | ZnF2 | NiF2 |
| 溶度积常数 | 1.46×10-10 | 7.42×10-11 | 3.04×10-2 | 微溶 |
(2)黄钠铁钒[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速度快,容易过滤等特点,常用于除铁.写出流程中第一次加入 Na2CO3溶液时反应的离子方程式:Na++3Fe3++2SO42-+3H2O+3CO32-=NaFe3(SO4)2(OH)6↓+3CO2↑;
(3)NiS的作用是除去溶液中的Cu2+,原理是NiS+Cu2+═CuS+Ni2+,该反应的平衡常数是8.43×104;
(4)滤液2中加入NaF的作用是除去溶液中的Ca2+、Mg2+,则加入NaF先沉淀的离子是Mg2+.
(5)NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由NiCO3为原料获得,结合上述流程,制备NiSO4•6H2O的操作步骤如下:
①向被有机萃取剂萃取后所得的水层中加入足量Na2CO3溶液(流程中第二次加Na2CO3溶液),搅拌,得NiCO3沉淀:
②过滤,并用蒸馏水洗涤沉淀2-3次直至流出液用pH试纸检验呈中性;
③向沉淀中加6mol/L的H2SO4溶液,直至恰好完全溶解;
④蒸发、冷却结晶并从溶液中分离出晶体;
⑤用少量乙醇洗涤并晾干.
确定步骤①中Na2CO3溶液足量,碳酸镍己完全沉淀的简单方法是:上层清液呈无色(或静置后向上层液中再加入Na2CO3溶液后没有沉淀生成);
补充完整上述步骤②和③【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】.
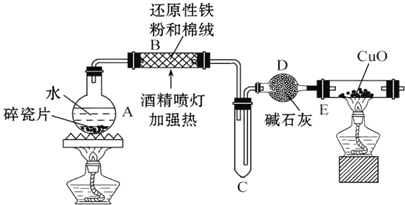 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题: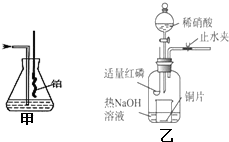 Ⅰ、实验室模拟氨催化氧化的装置如图甲:
Ⅰ、实验室模拟氨催化氧化的装置如图甲: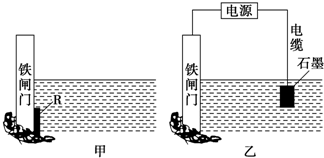 下面两个图都是金属防护的例子.
下面两个图都是金属防护的例子.