题目内容
13.下列关于化学键及晶体的说法中,不正确的是( )| A. | Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大 | |
| B. | NaOH和NH4Cl化学键类型相同 | |
| C. | N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 石英晶体是原子晶体,其分子式为SiO2 |
分析 A.卤素单质都是分子晶体,熔沸点的高低与分子间作用力的大小有关;
B.NaOH和NH4Cl均含有离子键和共价键;
C.根据原子中的最外层电子和形成的共用电子对判断;
D.只有分子晶体中有分子.
解答 解:A.卤素单质都是分子晶体,熔沸点的高低与分子间作用力的大小有关,而决定分子间作用力在因素是相对分子量的大小,故A正确;
B.NaOH中钠离子和氢氧根离子形成离子键,O与H形成共价键,NH4Cl中铵根离子和氯离子形成离子键,N与H形成共价键,均含有离子键和共价键,故B正确;
C.N2中N原子中的最外层电子为5,形成3个共用电子对,所以每个原子的最外层都具有8电子稳定结构,CCl4中每个原子的最外层都具有8电子稳定结构,故C正确;
D.只有分子晶体中有分子,石英晶体是原子晶体,不存在分子,其化学式为SiO2,故D错误.
故选D.
点评 本题考查了分子间作用力、晶体类型的判断、晶体熔沸点的比较等,题目难度不大,侧重于基础知识的考查,注意把握8电子稳定结构的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列装置进行的相应实验,能达到实验目的是( )

| A. | 用图1装置制取并收集干燥纯净的NH3 | |
| B. | 用图2装置可演示NO的喷泉实验 | |
| C. | 用图3装置制备Fe(OH)2并能较长时间观察其颜色 | |
| D. | 用图4装置验证苯中是否有独立的碳碳双键 |
1.用KMnO4酸性溶液处理Cu2S固体时,发生如下反应:MnO4-+Cu2S+H+→Cu2++SO2+Mn2++H2O(未配平).下列说法正确的是( )
| A. | 该离子反应配平后H2O的系数22 | |
| B. | MnO4-是氧化剂,既Cu2S是氧化剂又是还原剂 | |
| C. | 氧化性:MnO4-<Cu2+ | |
| D. | 生成2.24L(标况下)SO2时反应中转移电子的物质的量是0.6 mol |
8.下列属于酸性氧化物的是( )
| A. | 水 | B. | 一氧化碳 | C. | 氧化钠 | D. | 二氧化硫 |
5.某NaHCO3样品中混有少量的Na2CO3,下列测定该样品纯度的实验方案中不能达到实验目的是( )
| A. | 取样品mg,配成100ml溶液,取25.00mL于锥形瓶中,滴加几滴石蕊试液,用浓度为cmol/L的标准盐酸滴定至终点时,消耗盐酸Vml | |
| B. | 取样品mg,充分加热,冷却,称量固体的质量为n1g | |
| C. | 取样品mg,滴加足量的BaCl2溶液,过滤,洗涤,于燥后称量固体的质量为n2g | |
| D. | 取样品mg,滴加足量的Ba(OH)2过滤,洗涤,干燥后称量固体的质量为n3g |
2.下列说法正确的是( )
| A. | 珍珠、玛瑙、红宝石、水晶的主要成分都是硅酸盐 | |
| B. | 工业上冶炼金属Mg、Cu都采用热还原法 | |
| C. | 氯水、醋酸、小苏打都是电解质 | |
| D. | 利用丁达尔效应可以区别NaCl溶液和Fe(OH)3胶体 |

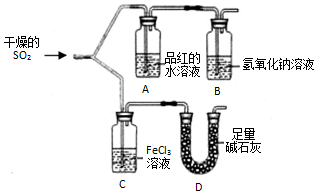 如图装置进行SO2气体性质实验.
如图装置进行SO2气体性质实验.