题目内容
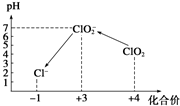
15. 已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )
已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )| A. | a点反应的还原剂是NaHSO3,被氧化的元素是碘元素 | |
| B. | b点反应的离子方程式是:3HSO3-+IO3-+3OH-═3SO42-+I-+3H2O | |
| C. | c点到d点的反应中共转移0.6mol电子 | |
| D. | 往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+2IO3-═I2+5SO42-+3H++H2O |
分析 还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,根据发生的反应来判断各个点的产物.
解答 解:还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,
A.a点反应离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,还原剂是NaHSO3,被氧化的元素是S元素,故A错误;
B.b点反应的离子方程式是:3HSO3-+IO3-═3SO42-+I-+3H+,故B错误;
C.c点到d点的反应离子方程式是IO3-+6H++5I-═3H2O+3I2,反应中生成0.3molI2,则转移电子为0.5mol,故C错误;
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,生成硫酸钠和单质碘,发生的反应为:5HSO3-+2IO3-═I2+5SO42-+3H++H2O,故D正确.
故选D.
点评 本题考查了氧化还原反应、离子方程式的有关知识,明确氧化性、还原性前后顺序是解本题关键,结合方程式进行分析解答,易错点是D,根据物质间的反应并结合原子守恒计算,难度中等.

练习册系列答案
相关题目
12.下列选用的相关仪器,用品不符合实验要求的是( )
| 选项 | 实验 | 仪器用品 |
| A | 准确量取19.01mL水 | 25mL酸式滴定管 |
| B | 新制氯水的保存 | 带玻璃塞的棕色细口瓶 |
| C | 测定0.1mol•L-1的Na2CO3溶液的pH | 镊子、pH试纸、表面皿 |
| D | 分离水和乙酸乙酯 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
6.下列微粒中,核外电子总数为10的是( )
| A. | Na+ | B. | CO2 | C. | CO | D. | N2 |
20.下列有关电解质溶液的说法正确的是( )
| A. | 将NaHCO3、Na2SO3、FeCl3溶液蒸干灼烧均得不到原溶质 | |
| B. | 保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 | |
| C. | 室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
7.下列操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
4.如图是元素周期表的一部分,关于元素X、Y、Z的叙述不正确的是( )
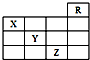

| A. | Z的原子序数比Y大19 | |
| B. | Z的单质常温下是深棕色液体,具有氧化性 | |
| C. | 同浓度的Y、Z的气态氢化物的水溶液的酸性Y>Z | |
| D. | X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐 |
5.NA为阿伏加德罗常数的值,下列叙述一定正确的是( )
| A. | 0.1mol铜粉在0.05mol氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 常温常压下,22.4L氙气中含有NA个氙分子 | |
| C. | 一定量的浓H2SO4与0.1molMg恰好完全反应,生成SO2为0.1NA | |
| D. | 标准状况下,22.4L由SO2和O3组成的混合气体中含有3NA个原子 |