题目内容
5. 一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )| A. | 反应方程式中的x=1 | |
| B. | t3时刻改变的条件是移去少量物质D | |
| C. | t2时刻改变的条件是使用催化剂 | |
| D. | t1~t3间该反应的平衡常数均为4 |
分析 根据图可知,在t2时刻,平衡不移动,但C的浓度变大,说明在在t2时刻改变的条件是缩小容器的体积,且该反应前后气体体积不变,所以可知x=2,再根据平衡常数的定义计算平衡常数,在可逆反应中固体物质的量的少量改变不会引起平衡的移动,据此答题.
解答 解:A、根据图可知,在t2时刻,平衡不移动,但C的浓度变大,说明在在t2时刻改变的条件是缩小容器的体积,且该反应前后气体体积不变,所以可知x=2B、由A中的分析可知x=2,故A错误;
B、由于D为固体,移去少量物质D,平衡不移动,不会改变其它物质的浓度,故B错误;
C、根据图可知,在t2时刻,平衡不移动,但C的浓度变大,说明在在t2时刻改变的条件是缩小容器的体积,催化剂不能改变平衡时的浓度,故C错误;
D、根据图可知,在t2时刻,平衡不移动,但C的浓度变大,说明在在t2时刻改变的条件是缩小容器的体积,且该反应前后气体体积不变,所以可知x=2,所以化学方程式为:A(g)+B(g)?2C(g)+D(s),根据方程式中的计量关系可知,在t1时刻达到平衡,生成0.5mol/LC,则A、B平衡的浓度均为0.25mol/L,所以平衡常数K=$\frac{0.{5}^{2}}{0.25×0.25}$=4,而t1~t3间温度没变,所以平衡常数不变,故D正确;
故选D.
点评 本题主要考查了根据图象判断影响平衡移动的因素,中等难度,解题的关键在于根据图象确定化学方程式中的x的值.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则下列叙述中正确的是( )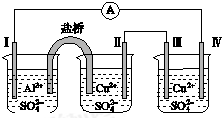

| A. | 电极Ⅰ发生还原反应 | B. | 电流方向:电极Ⅳ→ →电极Ⅰ →电极Ⅰ | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-═Cu |
16.在石墨晶体中,每一层有无数个正六边形构成,同一层内每个碳原子与相邻的三个碳原子以C-C键相结合.则石墨晶体中碳原子数与C-C键之比为( )
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
10.用一种试剂就能将下列五种有机物区分开来,①乙酸;②乙醛;③苯;④苯酚;⑤四氯化碳;这种试剂可以是( )
| A. | . 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 新制的氢氧化铜悬浊液 | D. | 氯化铁溶液 |
17.下列说法正确的是( )
| A. | 反应是吸热还是放热的,须看反应物和生成物所具有总能量的大小 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 需要加热方能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl的反应为放热反应 |
14.下列说法中正确的是(NA表示阿伏加德罗常数的数值)( )
| A. | 71g氯气含有的原子数目为NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数目为0.1NA | |
| C. | 标准状况下,22.4LH2O中含有的分子数为NA | |
| D. | 在标准状况下,22.4 L甲烷与乙炔的混合物所含分子数为NA |
6.下列选项中的物质不属于同分异构体的是( )
| A. | CH3CH=CH2和  | B. | 乙炔和苯 | C. |  和 和 | D. | 葡萄糖与果糖 |
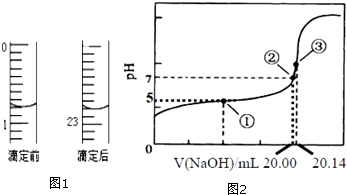 醋酸是日常生活中常见的弱酸.
醋酸是日常生活中常见的弱酸.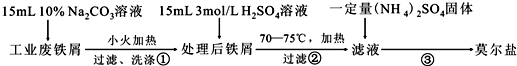
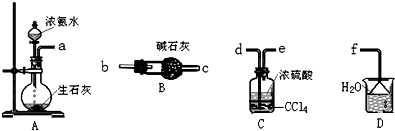
 案.
案.