题目内容
在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:2A(g)+B(g)?2C(g),经4s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的
.
(1)达到平衡时,C的物质的量浓度
(2)达到平衡时,A的转化率 .
(3)达到平衡时,用物质B表示的化学反应速率为 .
| 5 |
| 6 |
(1)达到平衡时,C的物质的量浓度
(2)达到平衡时,A的转化率
(3)达到平衡时,用物质B表示的化学反应速率为
考点:化学平衡的计算
专题:
分析:根据一定条件下,压强之比等于物质的量之比,求出平衡时,容器内混合气体的总的物质的量;根据反应方程式,运用三段式解题法,列方程求解平衡时,体系各组分的物质的量;再根据要求逐题解答.
解答:
解:设参加反应的B的物质的量为xmol,则:
2A(g)+B(g)?2C(g)
开始 2mol 1mol 0mol
变化 2xmol xmol 2xmol
平衡 (2-2x)mol (1-x)mol 2xmol
所以,(2-2x)mol+(1-x)mol+2xmol=(2mol+1mol)×
解得:x=0.5
(1)达到平衡时,C的物质的量浓度为
=0.2mol/L,故答案为:0.2mol/L
(2)达到平衡时,A的转化率为
×100%=50%,故答案为:50%;
(3)以B表示的该反应的速率v(B)=
=
=0.025 mol/(L.s),故答案为:0.025 mol/(L.s).
2A(g)+B(g)?2C(g)
开始 2mol 1mol 0mol
变化 2xmol xmol 2xmol
平衡 (2-2x)mol (1-x)mol 2xmol
所以,(2-2x)mol+(1-x)mol+2xmol=(2mol+1mol)×
| 5 |
| 6 |
(1)达到平衡时,C的物质的量浓度为
| 2×0.5mol |
| 5L |
(2)达到平衡时,A的转化率为
| 2×0.5mol |
| 2mol |
(3)以B表示的该反应的速率v(B)=
| △c |
| △t |
| ||
| 4s |
点评:本题考查了化学平衡的有关计算,难度不大,明确“三段式”法是化学平衡计算常用的解题方法,应熟练掌握.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
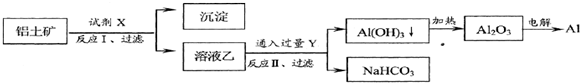
对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A、试剂X为稀硫酸 |
| B、结合质子( H+)的能力由强到弱的顺序是:AlO2->OH->CO32- |
| C、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物2.39g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5g白色沉淀,则a的数值为( )
| A、3.41 | B、3.21 |
| C、3.19 | D、3.59 |
将一枚洁净的铁钉浸入稀硫酸中,下列叙述:①铁钉表面产生气泡;②液体由无色逐渐变为浅绿色;③铁钉的质量减轻;④溶液的质量减轻,其中正确的是( )
| A、②③ | B、①②④ |
| C、①②③ | D、①②③④ |

