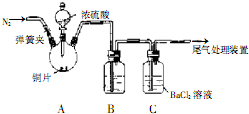
题目内容
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物2.39g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5g白色沉淀,则a的数值为( )
| A、3.41 | B、3.21 |
| C、3.19 | D、3.59 |
考点:有关混合物反应的计算
专题:
分析:Fe2O3、ZnO、CuO的固体混合在加热条件下用足量CO还原,得到金属与CO2,CO2用石灰水吸收生成CaCO3沉淀,根据碳元素守恒n(CO2)=n(CaCO3),1个CO获得1个O原子形成CO2,则固体混合物中n(O)=n(CO2),固体混合物质量=金属质量+氧原子质量,据此解答.
解答:
解:Fe2O3、ZnO、CuO的固体混合在加热条件下用足量CO还原,得到金属与CO2,CO2用石灰水吸收生成CaCO3沉淀,根据碳元素守恒n(CO2)=n(CaCO3)=
=0.05mol,1个CO获得1个O原子形成CO2,则固体混合物中n(O)=n(CO2)=0.05mol,则固体混合物质量=2.39g+0.05mol×16g/mol=3.19,故选C.
| 5g |
| 100g/mol |
点评:本题考查混合物计算,注意利用守恒思想计算混合物中氧原子物质的量,难度中等.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B、常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D、当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
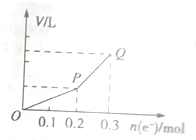 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A、0.1molCuO |
| B、0.1molCuCO3 |
| C、0.1molCu(OH)2 |
| D、0.05molCu2(OH)2CO3 |
 将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃下发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a KJ?mol-1,如图所示,下列分析中正确的是( )
将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃下发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a KJ?mol-1,如图所示,下列分析中正确的是( )| A、250℃时,0~10minH2反应速率为0.015mol?(L?Min)-1 |
| B、平衡时CO的转化率:T℃时小于250℃时 |
| C、a>0 |
| D、平衡常数K:T℃时大于250℃ |
下列说法不正确的是( )
| A、在固定容积的密闭容器中发生反应:A(s)+B(g)?C(g)+D(g),当混合气体的密度不再改变时,说明反应已达到化学平衡状态 | ||
| B、对于反应C(s)+CO2(g)?2CO(g)△H>0,改变某一条件,若化学平稳常数增大,则反应速率也一定增大 | ||
C、向01mol?L-1的NH3?H2O中加入氯化铵固体,则溶液中
| ||
D、常温下向Mg(OH)2悬浊液中加入MgCl2溶液,溶液中
|
某课外小组同学通过实验发现钾和钠的化学性质相似.下列解释最合理的是( )
| A、都属于金属元素 |
| B、原子半径相差不大 |
| C、元素的最高正化合价相同 |
| D、原子的最外层电子数相同 |