题目内容
工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
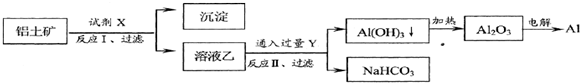
对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A、试剂X为稀硫酸 |
| B、结合质子( H+)的能力由强到弱的顺序是:AlO2->OH->CO32- |
| C、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
考点:物质分离和提纯的方法和基本操作综合应用,铝的化学性质
专题:
分析:Al2O3、Fe2O3和硫酸反应,要将氧化铝和Fe2O3分离出来,应该选择氢氧化钠,将氧化铝溶解为偏铝酸钠,则固体难溶物是氧化铁,即试剂X为氢氧化钠,沉淀中含有氧化铁,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,发生CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,Y为CO2,氢氧化铝加热分解生成氧化铝,电解可得铝,以此解答该题.
解答:
解:A.Al2O3、Fe2O3和硫酸反应,要将氧化铝和Fe2O3分离出来,应该选择氢氧化钠,将氧化铝溶解为偏铝酸钠,故A错误;
B.CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-可说明结合质子( H+)的能力AlO2->CO32-,但OH-最强,故B错误;
C.为CO2,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,发生CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故C正确;
D.熔融AlCl3不导电,为共价化合物,工业用电解熔融的氧化铝冶炼铝,故D错误.
故选C.
B.CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-可说明结合质子( H+)的能力AlO2->CO32-,但OH-最强,故B错误;
C.为CO2,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,发生CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故C正确;
D.熔融AlCl3不导电,为共价化合物,工业用电解熔融的氧化铝冶炼铝,故D错误.
故选C.
点评:本题以铁、铝化合物的性质为载体综合考查工业冶炼铝等知识,侧重于考查学生分析和解决问题的能力,综合性强,为高考常见题型,注意把握制备原理和反应的流程,难度中等.

练习册系列答案
相关题目
某水溶液中只可能含有下列离子中的若干种:K+、Mg2+、Fe3+、Al3+、NH4+、NO3-、Cl-、CO32-和SO42-.现每次取5mL进行实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加入足量NaOH后加热,收集到气体1.12L(标准状况下)
③第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g
下列说法不正确的是( )
①第一份加入AgNO3溶液有沉淀产生
②第二份加入足量NaOH后加热,收集到气体1.12L(标准状况下)
③第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g
下列说法不正确的是( )
| A、上述实验无法确定是否含有Cl-和NO3- |
| B、溶液中肯定含有CO32-和SO42-,且浓度分别为4.00mol/L、2.00mol/L |
| C、上述实验确定溶液中肯定不含有Mg2+、Fe3+、Al3+ |
| D、要确定是否含有K+,应进一步做焰色反应实验 |
下列说法中正确的是( )
| A、常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B、常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D、当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
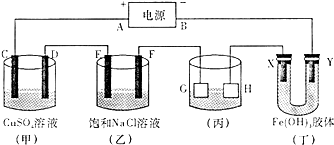 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是( )| A、电源B端是正极 |
| B、(甲)装置的C、D电极均有单质生成,且其物质的量之比为2:1 |
| C、欲用(丙)装置给铜镀银,H应该是银,电镀液是硝酸银溶液 |
| D、若向(乙)中滴入酚酞溶液,在F极附近先出现红色 |
 A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验: