题目内容
7.按要求作答:(1)写出氢氧化铜和盐酸反应的离子方程式2H++Cu(OH)2=Cu2++2H2O;
(2)写出实验室制CO2反应的离子方程式CaCO3+2H+=Ca2++H2O+CO2↑;
(3)除去Na2SO4溶液中的Na2CO3杂质,选用的试剂是稀硫酸,写出对应反应的离子方程式CO32-+2H+=H2O+CO2↑.
分析 (1)氢氧化铜与稀盐酸反应生成硫化铜水,氢氧化铜需要保留化学式;
(2)实验室中用碳酸钙与强酸反应制取二氧化碳气体;
(3)碳酸钠与稀硫酸反应生成硫酸钠、二氧化碳和水,可以用稀硫酸除去硫酸钠中的碳酸钠.
解答 解:(1)稀盐酸和氢氧化铜反应的离子反应为:2H++Cu(OH)2=Cu2++2H2O,
故答案为:2H++Cu(OH)2=Cu2++2H2O;
(2)实验室中制取二氧化碳的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)除去Na2SO4溶液中的Na2CO3杂质,可用稀硫酸将碳酸钠转化成硫酸钠,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,
故答案为:稀硫酸;CO32-+2H+=H2O+CO2↑.
点评 本题考查了离子方程式的书写,为高考的高频题,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
17.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
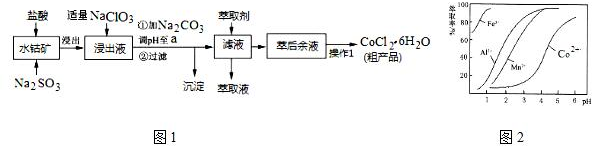
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
18.下列物质在一定条件下可以转化的是( )
| A. | CaCl2$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{高温}{→}$CaO | B. | Fe$\stackrel{少量Cl_{2}}{→}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 | ||
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | D. | SiO2$\stackrel{水}{→}$H2SiO3$\stackrel{NaOH溶液}{→}$Na2SiO3 |
2.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )


| A. | c点对应的溶液中大量存在的离子可能为:Na+、H+、Cl-、NO3- | |
| B. | 将25℃时的KCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 | |
| C. | t℃<25℃ | |
| D. | ac线上的任意一点溶液均有c(H+)=c(OH-) |




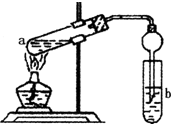 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.