题目内容
4.NOx的处理是当今环境保护的重要课题.(1)氢气催化还原法.发生的主要反应有
2NO(g)+4H2(g)+O2(g)=N2(g)+4H2O(g)△H=-1148kJ.mol-1
2H2(g)+O2(g)=2H2O(g)△H=-484kJ.mol-1
则2NO(g)+2H2(g)=N2(g)+2H2O(g)?H=-664kJ?mol-1
(2)碱液吸收法.以KMnO4作氧化剂,用NaOH溶液吸收时,NO被氧化为NO2-.反应中氧化剂与还原剂物质的量之比为1:1,反应的离子方程式为NO+MnO4-+2OH-=NO2-+MnO42-+H2O.将吸收液酸化后,所得HNO2可与尿素[CO(NH2)2]反应,生成两种无害气体,若处理过程中产生了3.36L(标准状况)气体,则转移电子0.3mol.
(3)酸液吸收法.NO被氧化后,吸收生成NO3-和NO2-.将NO与空气混合后通入HNO3溶液,测得尾气中NOx体积分数随$\frac{V(NO)}{V(空气)}$[设a=$\frac{V(NO)}{V(空气)}$]及硝酸浓度的变化关系如图1所示.
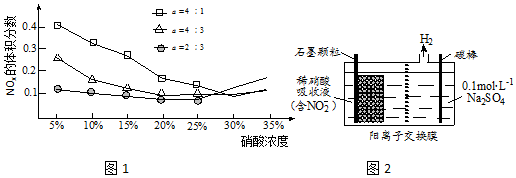
①实验测得,当a约为4:5时,尾气中NOx体积分数较小,其原因是此时,n(NO):n(NO2)=1:1,吸收后生成HNO2或n(NO):n(O2)=4:1,吸收后生成HNO2;
②当a较小时,HNO3浓度增大至25%以上,尾气中NOx体积分数增大的原因是如果硝酸的浓度太大,硝酸本身会分解出NOx,从而使排放的NOx比例升高.
③吸收液可用电解法进一步处理,其原理如图2所示.阳极的电极反应式为NO2-+H2O-2e-=NO3-+2H+.
分析 (1)根据已知方程式构建目标方程式,结合盖斯定律进行计算;
(2)该反应中锰元素化合价由+7价变为+2价,N元素化合价由+2价变为+3价,再根据氧化剂和还原剂的计量数之比以及原子守恒书写方程式;亚硝酸和尿素发生氧化还原反应生成两种无毒气体,根据元素守恒知,两种无毒气体应该是氮气和二氧化碳气体,根据方程式计算转移电子数;
(3)①NO被氧化后,吸收生成NO3-和NO2-,但当a约为4:5时,此时,n(NO):n(NO2)=1:1,生成HNO2;
②浓硝酸易分解生成氮的氧化物,从而使排放的NOx比例升高;
③电解池中阳极失电子发生氧化反应,为NO2-失去电子生成硝酸根离子,阴极氢离子得到电子生成氢气.
解答 解:(1)①2NO(g)+4H2(g)+O2(g)=N2(g)+4H2O(g)△H=-1148kJ.mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-484kJ.mol-1
根据盖斯定律:①-②得:2NO(g)+2H2(g)=N2(g)+2H2O(g)△H=(-1148kJ•mol-1)-(-484kJ•mol-1)=-664kJ•mol-1,
故答案为:-664;
(2)以KMnO4作氧化剂,用NaOH溶液吸收时,NO被氧化为NO2-,反应物为NO、MnO4-、OH-,产物有NO2-,N元素化合价由+2价变为+3价,NO为还原剂,反应中氧化剂与还原剂物质的量之比为1:1,反应的离子方程式为:NO+MnO4-+2OH-=NO2-+MnO42-+H2O,酸性条件下,亚硝酸和尿素发生氧化还原反应生成两种无毒气体,根据元素守恒知,两种无毒气体应该是氮气和二氧化碳气体,反应方程式为:CO(NH2)2+2HNO2=CO2↑+2N2↑+3H2O,每生成3mol气体转移6mol电子,若处理过程中产生了3.36L(标准状况)气体($\frac{3.36L}{22.4mol/L}$=0.15mol),则转移电子0.3mol,
故答案为:NO+MnO4-+2OH-=NO2-+MnO42-+H2O;0.3;
(3)①氧气在空气中体积分数为21%,当a约为4:5时,n(NO):n(O2)=4:1,此时,NO被氧化后,4NO+O2+2H2O=4HNO2,吸收生成HNO2,尾气中NOx体积分数较小,
故答案为:此时,n(NO):n(NO2)=1:1,吸收后生成HNO2或n(NO):n(O2)=4:1,吸收后生成HNO2;
②浓硝酸不稳定易分解,如果硝酸的浓度太大,硝酸本身会分解出NOx,从而使排放的NOx比例升高,
故答案为:如果硝酸的浓度太大,硝酸本身会分解出NOx,从而使排放的NOx比例升高;
③电解池中阳极阴离子NO2-失电子发生氧化反应,反应为:NO2-+H2O-2e-=NO3-+2H+,
故答案为:NO2-+H2O-2e-=NO3-+2H+.
点评 本题考查反应热计算、氧化还原反应、图象分析、电化学等知识,侧重考查学生分析计算能力,注意盖斯定律的熟练应用,(3)为该题的难点,掌握硝酸的性质以及电解池的工作原理为解答关键,题目难度中等.

| A. | 由原子构成的晶体不一定是原子晶体 | |
| B. | 分子晶体中的分子间可能含有共价键 | |
| C. | 分子晶体中一定有共价键 | |
| D. | 分子晶体中分子一定紧密堆积 |
| A. | 通氢气的一极是正极,通氧气的一极是负极 | |
| B. | 通氢气的一极发生的是还原反应 | |
| C. | 工作一段时间后电解质溶液的pH值减小 | |
| D. | 工作时负极区附近的pH值增大 |
| A. | 光化学烟雾的主要原因与排放SO2有关 | |
| B. | 工业上用二氧化硫来漂白纸浆、毛、丝、草帽、食品等 | |
| C. | 闪电时,大气中常伴有少量的NO2产生 | |
| D. | 正常雨水的PH小于5.6 |
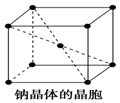 金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(molC-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )
金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(molC-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )| A. | $\root{3}{\frac{2a}{{N}_{A}ρ}}$ | B. | $\sqrt{2}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ | C. | $\frac{\sqrt{3}}{4}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ | D. | $\frac{1}{2}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ |
| A. | 动物体内的葡萄糖被氧化为CO2的过程是热能转化为化学能的过程 | |
| B. | 植物的光合作用是把太阳能转化为热能的过程 | |
| C. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| D. | 电解饱和食盐水是把化学能转化为电能 |
| A. | 都易溶于水 | |
| B. | 苯易挥发不能用作溶剂 | |
| C. | 乙醇和乙酸反应的有机产物的同分异构体中属于酯类的有4种 | |
| D. | CH3CH2OH→CH3CHO发生了加成反应 |
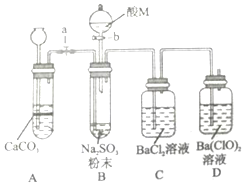 SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置:
SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置: