题目内容
10.下列离子方程式书写正确的是( )| A. | 实验室制取氯气 MnO2+4HCl(浓)═Mn2++2 Cl-+Cl2+2H2O | |
| B. | 少量的氢氧化钠溶液滴加到足量氯化铝溶液 Al3++4OH-═AlO2-+2H2O | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
分析 A.浓盐酸中氯化氢应拆成离子形式;
B.不符合反应客观事实;
C.电荷不守恒;
D.硅酸钠溶液中滴加盐酸生成硅酸和氯化钠.
解答 解:A.实验室制取氯气,离子方程式:MnO2+4H++2Cl-═Mn2++Cl2+2H2O,故A错误;
B.少量的氢氧化钠溶液滴加到足量氯化铝溶液,反应生成氢氧化铝,离子方程式:Al3++3OH-═Al(OH)3↓,故B错误;
C.利用腐蚀法制作印刷线路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.硅酸钠溶液中滴加盐酸,离子方程式:SiO32-+2H+═H2SiO3↓,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.消除氮氧化物污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)═4NO(g)+CO2(g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2(g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1),△H=-955 kJ•mol-1.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据是B C
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO) C.容器内压强保持不变 D.混合气体的密度保持不变 E.混合气体的平均相对分子质量保持不变
②计算该温度下该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是减小CO2浓度.
(3)甲烷燃料电池可以提升能量利用率,如图是利用甲烷燃料电池电解50mL2mol/L的氯化铜溶液的装置示意图:
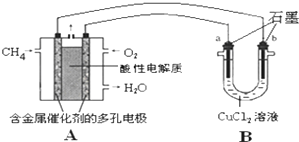
请回答:
①甲烷燃料电池的负极反应式是CH4-8e─+2H2O=CO2+8H+
②当A中消耗0.15mol氧气时,B中b(用a或b 表示)极增重19.2g.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)═4NO(g)+CO2(g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2(g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1),△H=-955 kJ•mol-1.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO) C.容器内压强保持不变 D.混合气体的密度保持不变 E.混合气体的平均相对分子质量保持不变
②计算该温度下该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是减小CO2浓度.
(3)甲烷燃料电池可以提升能量利用率,如图是利用甲烷燃料电池电解50mL2mol/L的氯化铜溶液的装置示意图:

请回答:
①甲烷燃料电池的负极反应式是CH4-8e─+2H2O=CO2+8H+
②当A中消耗0.15mol氧气时,B中b(用a或b 表示)极增重19.2g.
18.下列物品或设备:①工业制粗硅 ②门窗玻璃 ③水晶项链 ④石英钟表 ⑤玛瑙手镯 ⑥硅太阳能电池 ⑦光导纤维 ⑧计算机芯片.所用材料为SiO2或要用到SiO2的是( )
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |
19.100mL浓度为2mol/L的盐酸跟略过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入适量的6mol/L的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入适量醋酸钠溶液 | D. | 加入适量的NaOH固体 |
20.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H>0.现将1molA和2molB加入 甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |

 ; F
; F ;
;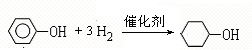 ;
;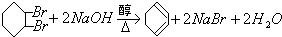 .
.