题目内容
17.下列物质中,分子内和分子间均可形成氢键的是( )| A. | NH3 | B. | B | C. | H2O | D. | C2H5OH |
分析 氢键比范德华力强,是一种介于化学键与分子间作用力之间的作用力,含F、O、N元素的物质中分子内或分子之间能形成氢键,以此来解答.
解答 解:A.因N的电负性较大,则氨气分子之间能形成氢键,NH3分子内不含氢键,故A不选;
B. 中含有2个氧原子,因O的电负性较大,则既能形成分子间氢键,也能形成分子内氢键,故B可选;
中含有2个氧原子,因O的电负性较大,则既能形成分子间氢键,也能形成分子内氢键,故B可选;
C.O的电负性较大,则水分子间存在氢键,水分子内不含氢键,故C不选;
D.因O的电负性较大,则乙醇分子之间能形成氢键,C2H5OH分子内不含氢键,故D不选;
故选B.
点评 本题考查形成氢键的条件,难度不大.要注意含氢键的物质与F、N、O三种元素有关是解答本题的关键.

练习册系列答案
相关题目
2.关于硫及其化合物说法正确的是( )
| A. | 自然界的硫元素主要以硫单质、硫化物和硫酸盐等形式存在 | |
| B. | 浓硫酸可作干燥剂,但不能干燥二氧化硫、氯气等气体 | |
| C. | 二氧化硫能使溴水褪色,说明其具有漂白性 | |
| D. | 浓硫酸中存在的主要是硫酸分子,常温下就能和铜片剧烈反应 |
8.一种熔融碳酸盐燃料电池的工作原理如图.下列有关该电池的说法不正确的是( )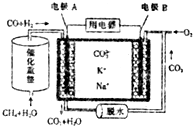

| A. | 电流方向:由B极经用电器流向A极 | |
| B. | 电极B上发生的电极反应为2CO2+O2+4e-═CO22- | |
| C. | 电池工作时,K+、Na+向电极B移动 | |
| D. | 若消耗电极B上的O233.6L(标准状况),则至少需要1moL CH4参加反应 |
5.已知NA为阿伏加德罗常数的值.有关草酸 (HOOC-COOH)的下列说法中错误的是( )
| A. | 9.0g草酸中共用电子对数目为0.9NA | |
| B. | 9.0 g草酸被NaClO氧化生成CO2,转移的电子数为0.2 NA | |
| C. | 9.0 g草酸溶于水,其中C2O42-和HC2O4-的微粒数之和为0.1NA | |
| D. | 9.0g草酸受热完全分解为CO2、CO、H2O,标况下测得生成的气体体积为4.48 L |
12.根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的是( )
①ClO3-+5Cl-+6H+═3Cl2+3H2O
②2FeCl3+2KI═2FeCl2+2KCl+I2
③2FeCl2+Cl2═2FeCl3.
①ClO3-+5Cl-+6H+═3Cl2+3H2O
②2FeCl3+2KI═2FeCl2+2KCl+I2
③2FeCl2+Cl2═2FeCl3.
| A. | ClO3->Cl2>I2>Fe3+ | B. | Cl2>ClO3->I2>Fe3+ | ||
| C. | ClO3->Cl2>Fe3+>I2 | D. | ClO3->Fe3+>Cl2>I2 |
2.下列有关试剂的保存方法,错误的是( )
| A. | 为防止水解,FeCl3溶液中加入少量稀硫酸 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
9.下列说法正确的是( )
| A. | 红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| B. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| C. | 氢氧燃料电池、丹尼尔电池、硅太阳能电池中都利用了原电池原理 | |
| D. | 纤维素、PLA、纤维二糖、甲壳素、硝化纤维等都是高分子化合物 |
7. 在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
 在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为2X=3Y+Z | |
| B. | t时,正、逆反应都不再继续进行,反应达到化学平衡 | |
| C. | 若t=4,则0~t的X的化学反应速率为0.1 mol•L-1•min-1 | |
| D. | 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大 |
