题目内容
17.三氯化铁是一种高效、廉价的净水剂,它是红棕色固体,易潮解,100℃左右时升华.实验室可用氯气与铁反应制备无水三氯化铁,装置如图所示.试回答:
(1)装置B中的试剂是浓硫酸;装置E的作用是防止水蒸气进入D装置.
(2)反应开始时应先点燃装置A处的酒精灯,过一会儿再点燃装置C处的酒精灯,此操作的目的是赶尽装置中的空气.
(3)欲用制得的FeCl3配制溶液,应先将装置D冷却后的固体粉末溶于盐酸(填药品名称)中,再用水稀释到所需的浓度.结合离子方程式简要说明原因若将FeCl3溶于水,Fe3+发生水解,Fe3++3H2O?Fe(OH)3+3H+,出现浑浊现象,将FeCl3溶于一定量的盐酸中,抑制Fe3+水解,得到澄清溶液.简述检验Fe3+的方法取少量溶液于试管中,滴入几滴KSCN溶液,溶液变红,则证明原溶液中有Fe3+.
分析 实验室用氯气和金属铁反应制备无水三氯化铁:A为分液漏斗盛放浓盐酸,圆底烧瓶盛放二氧化锰,浓盐酸和二氧化锰加热制取氯气:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,制取的氯气中含有水蒸气,B装置浓硫酸进行干燥氯气,装置C,在加热条件下,铁和氯气反应,反应方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,制得氯化铁,D用于收集生成的氯化铁,E可起到防止水蒸气进入D装置作用,F为尾气吸收装置,以此解答该题.
解答 解:实验室用氯气和金属铁反应制备无水三氯化铁:A为分液漏斗盛放浓盐酸,圆底烧瓶盛放二氧化锰,浓盐酸和二氧化锰加热制取氯气:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,制取的氯气中含有水蒸气,B装置浓硫酸进行干燥氯气,装置C,在加热条件下,铁和氯气反应,反应方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,制得氯化铁,D用于收集生成的氯化铁,E可起到防止水蒸气进入D装置作用,F为尾气吸收装置,
(1)由以上分析可知B中试剂为浓硫酸,起到干燥氯气的作用,装置E的作用是防止水蒸气进入D装置,故答案为:浓硫酸;防止水蒸气进入D装置;
(2)装置中有2处可加热,应先加热A处酒精灯,生成氯气充满装置,可排除装置内的空气,故答案为:A;C;赶尽装置中的空气;
(3)因铁离子易水解生成氢氧化铁,发生Fe3++3H2O?Fe(OH)3+3H+,出现浑浊现象,在配制溶液时,应先将FeCl3溶于一定量的盐酸中,可抑制铁离子的水解,以得到澄清溶液,如检验铁离子,可取少量溶液于试管中,滴入几滴KSCN溶液,溶液变红,则证明原溶液中有Fe3+,
故答案为:盐酸;若将FeCl3溶于水,Fe3+发生水解,Fe3++3H2O?Fe(OH)3+3H+,出现浑浊现象,将FeCl3溶于一定量的盐酸中,抑制Fe3+水解,得到澄清溶液;取少量溶液于试管中,滴入几滴KSCN溶液,溶液变红,则证明原溶液中有Fe3+.
点评 本题以氯化铁的制备为载体,考查了氯气的制备和性质的检验、实验装置的优劣分析,解题关键理在于明确实验原理和目的及各装置的作用,题目难度中等,有利于培养学生的分析能力和实验能力.

| A. | Na+ 1s22s22p6 | B. | F?1s22s22p6 | C. | N3+ 1s22s22p6 | D. | O2?1s22s22p6 |
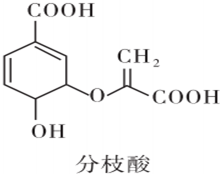
| A. | 其分子式为C10H8O6 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1 mol分枝酸在一定条件下最多可与3 mol NaOH发生反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠的水解 HCO3-+H2O=H2CO3+OH- | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
| A. | KNO3 CH3COOH | B. | HCl NaHSO4 | C. | NaCl BaSO4 | D. | NH3•H2O H2SO4 |
| A. | 镀锌铁板 | B. | 镀铜铁板 | C. | 镀锡铁板 | D. | 镀铅铁板 |
| A. | 1mol Cl2中约含有6.02×1023个氯原子 | |
| B. | 1mol OH-的质量为17g | |
| C. | 1mol O2的体积约为22.4L | |
| D. | 1mol氢中含有2mol 电子 |
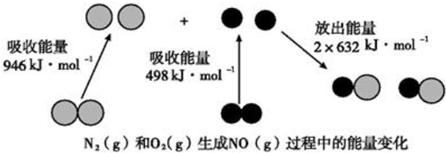
| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | 1mol N2(g)和1mol O2(g)具有的总能量小于2molNO(g)具有的总能量 | |
| C. | 该反应中反应物断开化学键所吸收的总能量小于生成物形成化学键所释放出的总能量 | |
| D. | 恒容密闭容器中,充入Ar气,该反应速率加快 |