题目内容
4.乙烯、乙炔、邻二甲苯相比较,下列叙述不正确的是( )| A. | 都能燃烧,生成 CO2 和 H2O | |
| B. | 邻二甲苯另有三种属于芳香烃的同分异构体 | |
| C. | 乙烯和乙炔易发生加成反应,邻二甲苯能发生取代反应 | |
| D. | 乙烯和乙炔易使酸性 KMnO4 溶液褪色,而邻二甲苯不能 |
分析 乙烯、乙炔、邻二甲苯都为烃,含有C、H元素,乙烯含有碳碳双键,乙炔含有碳碳三键,可发生加成、加聚和氧化反应,邻二甲苯含有甲基,可发生取代、氧化反应,以此解答该题.
解答 解:A.都为烃,含有C、H元素,都能燃烧,生成 CO2 和 H2O,故A正确;
B.邻二甲苯的同分异构体有间二甲苯、对二甲苯以及乙苯等,故B正确;
C.乙烯和乙炔含有碳碳不饱和键,易发生加成反应,邻二甲苯的甲基和苯环都能发生取代反应,故C正确;
D.邻二甲苯含有甲基,可被酸性高锰酸钾氧化,故D错误.
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系即可解答,侧重考查基本概念及物质结构,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
15.下列物质的主要成分不是SiO2的是( )
| A. | 石英 | B. | 水晶 | C. | 金刚砂 | D. | 玛瑙 |
12.下列物质前者是强电解质、后者是弱电解质的是( )
| A. | KNO3 CH3COOH | B. | HCl NaHSO4 | C. | NaCl BaSO4 | D. | NH3•H2O H2SO4 |
19.下列物质中属于弱电解质的是( )
| A. | CO2 | B. | NH3•H2O | C. | NH4NO3 | D. | 酒精 |
9.下列叙述正确的是( )
| A. | 1mol Cl2中约含有6.02×1023个氯原子 | |
| B. | 1mol OH-的质量为17g | |
| C. | 1mol O2的体积约为22.4L | |
| D. | 1mol氢中含有2mol 电子 |
13.下列各组中两个反应的反应热,其中△H1>△H2( )
| A. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 | |
| C. | 2SO2(g)+O2(g)═2SO3(g)△H1;2SO3(g)═O2(g)+2SO2(g)△H2 | |
| D. | 已知反应:C(金刚石,s)═C(石墨,s)△H<0,C(金刚石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2 |
14.海水是巨大的资源宝库,海水中主要离子的含量如表所示.
从海水中提取食盐和溴的工艺流程如图:
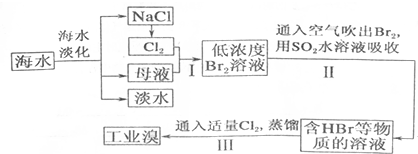
(1)请列举海水淡化的一种方法蒸留法或电渗透法或离子交换法等.
(2)请写出步骤I反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(3)步骤I中已经获得Br2,步骤II中又将获得的Br2还原为Br-,其目的是富集溴元素.
(4)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(5)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解)
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)请列举海水淡化的一种方法蒸留法或电渗透法或离子交换法等.
(2)请写出步骤I反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(3)步骤I中已经获得Br2,步骤II中又将获得的Br2还原为Br-,其目的是富集溴元素.
(4)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(5)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解)
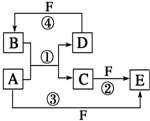 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)