题目内容
7.现有下列八种物质:①Na2CO3、②NaHCO3、③CH3COONa、④NH4HCO3、⑤C2H5OH ⑥Al ⑦食盐水 ⑧CH3COOH.(1)上述物质中属于强电解质的是①②③④(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是②④⑥(填序号).
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-.
(3)④跟足量的浓NaOH溶液在加热条件下反应的离子方程式是:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O.
分析 (1)①Na2CO3是盐,属于强电解质,只能与盐酸反应;
②NaHCO3属于盐,是强电解质,既能与盐酸反应生成二氧化碳气体,又能与氢氧化钠反应生成碳酸钠;
③CH3COONa属于强碱弱酸盐,是强电解质,和盐酸溶液反应;
④NH4HCO3属于盐,既能与酸反应生成二氧化碳气体,又能与碱反应生成氨气;
⑤C2H5OH属于非电解质;
⑥Al是单质,既能跟NaOH溶液反应,又能跟盐酸反应;
⑦食盐水属于混合物;
⑧CH3COOH是弱酸,属于弱电解质,和氢氧化钠溶液反应;
(2)②的水溶液呈碱性是因为碳酸氢根离子水解促进水的电离,溶液中氢氧根离子浓度增大;
(3)④跟足量的浓NaOH溶液在加热条件下反应生成氨气、碳酸钠和水.
解答 解:(1)①Na2CO3是盐,属于强电解质,只能与盐酸反应;
②NaHCO3属于盐,是强电解质,既能与盐酸反应生成二氧化碳气体,又能与氢氧化钠反应生成碳酸钠;
③CH3COONa属于强碱弱酸盐,是强电解质,和盐酸溶液反应;
④NH4HCO3属于盐,既能与酸反应生成二氧化碳气体,又能与碱反应生成氨气;
⑤C2H5OH属于非电解质;
⑥Al是单质,既能跟NaOH溶液反应,又能跟盐酸反应;
⑦食盐水属于混合物;
⑧CH3COOH是弱酸,属于弱电解质,和氢氧化钠溶液反应,
上述物质中属于强电解质的是①②③④,
故答案为:①②③④;②④⑥;
(2)碳酸氢钠属于强碱弱酸盐,水解呈碱性,离子反应方程式为:HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-+H2O?H2CO3+OH-;
(3)碳酸氢铵与氢氧化钠反应生成氨气和碳酸根,离子反应方程式为NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O,
故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O.
点评 本题主要考查的是电解质与强电解质的概念、Al的两性以及两性化合物,难度不大,注意离子反应方程式的正确书写是关键.

 阅读快车系列答案
阅读快车系列答案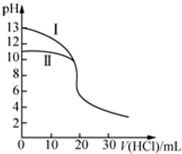
| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
| A. | 酒精和水 | B. | 四氯化碳和水 | C. | 乙酸和水 | D. | 汽油和苯 |
| A. | X分子中含有酯基和醛基 | |
| B. | X和Y相对分子质量之差为120 | |
| C. | X分子中有6个O原子,且水溶液显酸性 | |
| D. | Y分子可能结构有6种 |
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | 1×10-13 | 1×10-12 |
(1)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1;
(2)在t2℃下,将amol•L-1CH3COOH溶液与bmol•L-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=$\frac{b×1{0}^{-6}}{a-b}$(用a、b表示);
(1I)已知:25℃下,下列反应;
Ag+(aq)+2NH3(aq)?Ag2(NH3)2+(aq)△H=akJ•mol-1 k=c
2Ag+(aq)+2OH-(aq)?Ag2O(s)+H2O(I)△H=blJ•mol-1 k=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:Ag2O(s)+H2O(l)+4NH3(aq)?2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;计算25℃下,该反应的平衡常数(用c,d表示)k=$\frac{{c}^{2}}{d}$.
| A. | PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果 | |
| B. | sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 | |
| C. | 凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体 | |
| D. | AB3型的分子立体构型必为平面三角形 |
| A. | 含2molH2SO4的浓硫酸与足量铜反应生成1molSO2 | |
| B. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| C. | 铜与稀硝酸反应生成0.5molNO气体,则转移电子数为NA | |
| D. | 可用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2,不可用澄清石灰水鉴别 CO2和SO2 |
| A. | C元素的相对分子质量是12,则1mol C的质量为12g/mol | |
| B. | 1mol Cl2的体积为22.4L | |
| C. | 1mol CO2中含有3个原子 | |
| D. | 已知NaOH溶液的物质的量浓度为0.5mol/L,则2L该溶液中含NaOH 1mol |
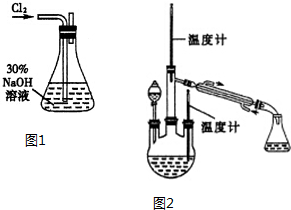 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).