题目内容
15.X、Y、Z、R均为短周期元素,X、Y、R同周期,其中R的质子数最大;X、Z同主族.X的原子结构示意图为: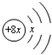 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )| A. | 对应氢化物的沸点:R>Z>X | |
| B. | Y、Z形成的化合物中只有离子键 | |
| C. | 离子半径:X>Z>Y | |
| D. | Z与X、Y与R形成化合物的晶体类型相同 |
分析 X、Y、Z、R均为短周期元素,X的原子结构示意图为: ,而x=2,故X为S元素,X、Z同主族,则Z为O元素,X、Y、R同周期,其中R的质子数最大,则R为Cl,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7,则Y为Na.
,而x=2,故X为S元素,X、Z同主族,则Z为O元素,X、Y、R同周期,其中R的质子数最大,则R为Cl,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7,则Y为Na.
解答 解:X、Y、Z、R均为短周期元素,X的原子结构示意图为: ,而x=2,故X为S元素,X、Z同主族,则Z为O元素,X、Y、R同周期,其中R的质子数最大,则R为Cl,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7,则Y为Na.
,而x=2,故X为S元素,X、Z同主族,则Z为O元素,X、Y、R同周期,其中R的质子数最大,则R为Cl,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7,则Y为Na.
A.X、Z、R对应的氢化物分别为H2S、H2O、HCl,水分子之间形成氢键,常温下为液态,另外两种为气态,相对分子质量越大,分子间作用力越强,沸点越高,故沸点H2O>HCl>H2S,故A错误;
B.Y、Z形成的化合物有Na2O、Na2O2,这两种物质中都含有离子键,但过氧化钠还含有共价键,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径S2->O2->Na+,故C正确;
D.Z与X形成的化合物为SO2、SO3,属于共价化合物,Y与R形成化合物为NaCl,属于离子化合物,故D错误.
故选:C.
点评 本题考查原子结构和元素周期律,涉及沸点比较、化学键、微粒半径比较等知识点,正确判断元素是解本题关键,注意非金属氢化物的熔沸点与分子间作用力及氢键有关.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
15.X、Y都是芳香族化合物,1molX水解得到1molY和2mol醋酸.Y相对分子质量介于100~150之间,且碳和氢两种元素的总质量分数为65.2%.X溶液能发生银镜反应,向Y水溶液中滴加NaHCO3无气泡,滴加FeCl3溶液显紫色.下列说法正确的是( )
| A. | X分子中含有酯基和醛基 | |
| B. | X和Y相对分子质量之差为120 | |
| C. | X分子中有6个O原子,且水溶液显酸性 | |
| D. | Y分子可能结构有6种 |
6.下列叙述正确的是( )
| A. | 含2molH2SO4的浓硫酸与足量铜反应生成1molSO2 | |
| B. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| C. | 铜与稀硝酸反应生成0.5molNO气体,则转移电子数为NA | |
| D. | 可用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2,不可用澄清石灰水鉴别 CO2和SO2 |
10.下列涉及有机物的说法正确的是( )
| A. | 甘油是一种油 | |
| B. | 乙烯、氯乙烯、苯乙烯都可用于合成有机高分子材料 | |
| C. | 苯能与溴发生反应,因此不能用苯萃取溴水中的溴 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖,因此二者互为同分异构体 |
7.下列说法正确的是( )
| A. | C元素的相对分子质量是12,则1mol C的质量为12g/mol | |
| B. | 1mol Cl2的体积为22.4L | |
| C. | 1mol CO2中含有3个原子 | |
| D. | 已知NaOH溶液的物质的量浓度为0.5mol/L,则2L该溶液中含NaOH 1mol |
4.对下面有机物的叙述不正确的是( )
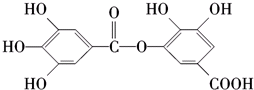

| A. | 常温下 可以和Na2CO3溶液反应生成CO2气体 | |
| B. | 在碱性条件下水解,0.5 mol 该物质完全反应可以消耗4 mol NaOH | |
| C. | 与稀H2SO4共热生成两种不同的有机物 | |
| D. | 该物质的化学式为C14H10O9 |
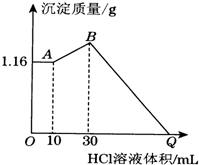 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答: