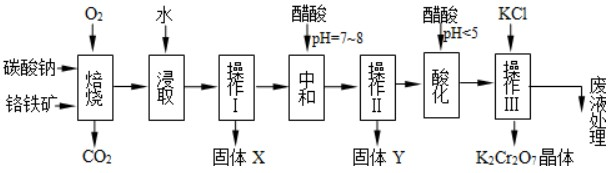
题目内容
A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl-、NO3-、CO32-中不同的阴、阳离子所组成.经实验A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡.则A为 、B为 .将B和C的溶液混合反应的化学方程式为: .
考点:物质的检验和鉴别的实验方案设计
专题:离子反应专题
分析:先根据离子共存判断离子之间的组合:Ag+只能结合NO3-形成硝酸银、剩下的离子中Ba2+只能结合Cl-形成氯化钡、最后的离子结合形成碳酸钠,然后根据A、B能够与盐酸反应的现象判断A、B组成,从而明确A、B、C的名称,书写B和C的溶液混合反应的化学方程式.
解答:
解:A、B、C为三种无色可溶盐,则Ag+只能结合NO3-形成AgNO3、剩下的离子中Ba2+只能结合Cl-形成BaCl2,另一种物质则为Na2CO3;
A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,则A为AgNO3;B与盐酸产生气泡,所以B为Na2CO3,C不与盐酸反应,则C为BaCl2,将B和C的溶液混合反应的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,
故答案为:AgNO3;Na2CO3;BaCl2+Na2CO3=BaCO3↓+2NaCl.
A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,则A为AgNO3;B与盐酸产生气泡,所以B为Na2CO3,C不与盐酸反应,则C为BaCl2,将B和C的溶液混合反应的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,
故答案为:AgNO3;Na2CO3;BaCl2+Na2CO3=BaCO3↓+2NaCl.
点评:本题考查了未知物的检验,题目难度不大,注意掌握常见物质的检验方法,明确常见物质的性质及反应现象是解答本题的关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
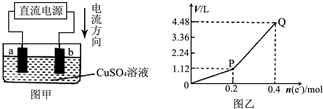 用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )
用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )| A、电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
| B、b电极上发生的反应方程式为:4OH--4e-=2H2O+O2↑ |
| C、曲线0~P段表示O2的体积变化 |
| D、从开始到Q点时收集到的混合气体的平均摩尔质量为12g?mol-1 |
下列表示物质结构的化学用语或模型图正确的是( )
A、H2O2的电子式: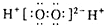 |
| B、结构简式(CH3)2CHOH可以表示1-丙醇,也可以表示2-丙醇 |
| C、二氧化硅的分子式:SiO2 |
| D、质子数为8,中子数为10的氧原子:818O |