题目内容
下列关于电负性的叙述中不正确的是( )
| A、电负性用来描述不同元素的原子对键合电子吸引力的大小 |
| B、电负性是以氟为4.0、锂为1.0作为标准的相对值 |
| C、元素电负性越小,元素非金属性越强 |
| D、元素电负性越大,元素非金属性越强 |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:A.根据电负性的含义分析;
B.根据电负性的标准分析;
C.元素的电负性越小,则元素的非金属性越弱;
D.根据电负性与元素性质的关系分析.
B.根据电负性的标准分析;
C.元素的电负性越小,则元素的非金属性越弱;
D.根据电负性与元素性质的关系分析.
解答:
解:A.根据电负性的含义,电负性用来描述不同元素的原子对键合电子吸引力的大小,故A正确;
B.根据电负性的标准:电负性是以氟为4.0、锂为1.0作为标准的相对值,故B正确;
C.元素的电负性越大,越易得电子,元素的非金属性越强,元素的电负性越小,则元素的非金属性越弱,故C错误;
D.元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,故D正确;
故选C.
B.根据电负性的标准:电负性是以氟为4.0、锂为1.0作为标准的相对值,故B正确;
C.元素的电负性越大,越易得电子,元素的非金属性越强,元素的电负性越小,则元素的非金属性越弱,故C错误;
D.元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,故D正确;
故选C.
点评:本题考查了电负性的含义,题目难度不大,注意根据电负性的含义进行剖析.

练习册系列答案
相关题目
1mol某烷烃完全燃烧消耗的O2为1l mol,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有( )
| A、4种 | B、5种 | C、6种 | D、7种 |
下列说法不正确的是( )
| A、工业上冶炼Fe用热还原方法 |
| B、海水淡化的方法主要有蒸馏法,电渗析法,离子交换法等 |
| C、工业上通过煤的干馏可获得芳香烃 |
| D、单质硅是将太阳能转变为电能的材料,二氧化硅可以做半导体材料 |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )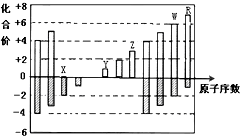

| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:W>R |
C、X的一种氢化物具有氧化性,其电子式为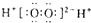 |
| D、Y和Z两者最高价氧化物对应的水化物能相互反应 |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、X与Y形成化合物,X可以显负价,Y显正价 |
| B、第一电离能可能Y小于X |
| C、气态氢化物的稳定性:HmY小于HnX |
| D、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的 |
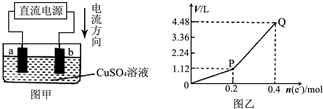 用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )
用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )| A、电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
| B、b电极上发生的反应方程式为:4OH--4e-=2H2O+O2↑ |
| C、曲线0~P段表示O2的体积变化 |
| D、从开始到Q点时收集到的混合气体的平均摩尔质量为12g?mol-1 |