题目内容
11.下列各溶液中,Na+物质的量浓度最大的是( )| A. | 200 mL 0.5mol/LNaCl溶液 | B. | 50 mL 0.3mol/LNa2SO4溶液 | ||
| C. | 150 mL 0.4mol/LNaOH | D. | 200mL0.15mol/LNa3PO4 |
分析 电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,据此结合选项判断.
解答 解:A、200ml 0.5mol•L-1的NaCl溶液中Na+浓度为0.5mol/L×1=0.5mol/L;
B、50mL 0.3mol/LNa2SO4溶液中Na+浓度为0.3mol/L×2=0.6mol/L;
C、150mL 0.4mol•L-1的NaOH溶液中Na+浓度为0.4mol/L×1=0.4mol/L;
D、200mL 0.15mol/LNa3PO4溶液Na+浓度为0.15mol/L×3=0.45mol/L;
故选B.
点评 本题考查物质的量浓度,比较基础,注意电解质溶液中离子的浓度与电解质浓度的计算,题目难度不大

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
1.下列不属于有机高分子化合物的是( )
| A. | 油脂 | B. | 蛋白质 | C. | 淀粉 | D. | 纤维素 |
2. 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 若Z是KCl溶液,则电解时溶液中Cl-向Y极移动 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 外加电流的阴极保护法中,Y是待保护金属 | |
| D. | 电解硫酸溶液一段时间后,加适量水可使溶液恢复到原溶液 |
3.下列说法中不正确的是( )
| A. | 每种烃的含氧衍生物中至少有3种元素 | |
| B. | 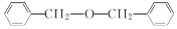 中含有的官能团为醚基 中含有的官能团为醚基 | |
| C. | 所有的有机物中都含有碳,多数含氢,其次还含有氧、氮、卤素、硫、磷等 | |
| D. | 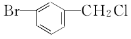 属于芳香卤代烃 属于芳香卤代烃 |
7.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者的pH比后者的大 | 元素非金属性:S>C |
| B | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液,试管口出现红棕色气体 | 溶液中NO被Fe2+还原为NO2 |
| C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
| D | 向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
8.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:
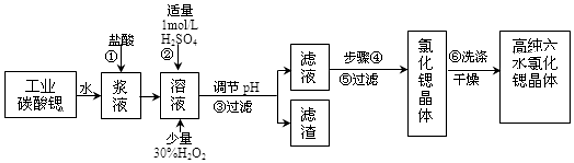
已知:Ⅰ.有关氢氧化物沉淀的pH:
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
请回答:
(1)在步骤②中加入少量的30%H2O2,反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为SrO、SrCO3或Sr(OH)2等.过滤所得滤渣的主要成分是Fe(OH)3和BaSO4 .
(3)关于上述流程中的步骤④、⑤、⑥的说法,正确的是A、B.
A.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B.可以通过降低结晶速率的方法来得到较大颗粒的SrCl2•6H2O 晶体
C.某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D.步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和SrCl2溶液
(4)工业上采用减压烘干或者用50~60℃的热风吹干SrCl2•6H2O晶体的原因是防止SrCl2•6H2O 晶体在61℃以上时失去结晶水.
(5)为了测定所得SrCl2•6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.200mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl2•6H2O晶体样品的纯度.用去上述浓度的NH4SCN溶液20.0mL,则原SrCl2•6H2O晶体的纯度为95.3%.

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
请回答:
(1)在步骤②中加入少量的30%H2O2,反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为SrO、SrCO3或Sr(OH)2等.过滤所得滤渣的主要成分是Fe(OH)3和BaSO4 .
(3)关于上述流程中的步骤④、⑤、⑥的说法,正确的是A、B.
A.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B.可以通过降低结晶速率的方法来得到较大颗粒的SrCl2•6H2O 晶体
C.某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D.步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和SrCl2溶液
(4)工业上采用减压烘干或者用50~60℃的热风吹干SrCl2•6H2O晶体的原因是防止SrCl2•6H2O 晶体在61℃以上时失去结晶水.
(5)为了测定所得SrCl2•6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.200mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl2•6H2O晶体样品的纯度.用去上述浓度的NH4SCN溶液20.0mL,则原SrCl2•6H2O晶体的纯度为95.3%.
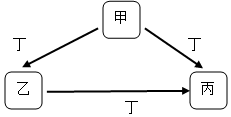 甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).
甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).


