题目内容
以下现象不涉及电化学原理的是( )
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、纯铝制品在空气中表面逐渐失去金属光泽 |
| C、锌与稀硫酸反应时,往溶液中滴入几滴CuSO4溶液可以使反应变快 |
| D、与电源的负极相连的金属不易生锈 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据是否能构成原电池以及电解池判断,如果金属能构成原电池的就能产生电化学腐蚀,否则不能产生电化学腐蚀,与电源负极相连的是阴极,是被保护的,据此分析解答.
解答:
解:A、黄铜(铜锌合金)制作的铜锣中,金属锌为负极,金属铜做正极,Cu被保护,不易腐蚀,和电化学腐蚀有关,故A不选;
B、在空气中铝表面迅速氧化形成保护层是因Al被氧化为氧化铝,与电化学无关,故B选;
C、锌置换出铜,形成原电池反应,进而加快反应速率,与电化学有关,故C不选;
D、与电源负极相连的金属作电解池的阴极,不发生变化,与电化学有关,故D不选,故选B.
B、在空气中铝表面迅速氧化形成保护层是因Al被氧化为氧化铝,与电化学无关,故B选;
C、锌置换出铜,形成原电池反应,进而加快反应速率,与电化学有关,故C不选;
D、与电源负极相连的金属作电解池的阴极,不发生变化,与电化学有关,故D不选,故选B.
点评:本题考查金属的腐蚀,注意在原电池中,负极金属易被腐蚀,正极金属被保护,在电解池中,阳极被腐蚀,阴极被保护,明确化学腐蚀和电化学腐蚀的区别即可解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,将熟石灰加入一定体积的水中,形成悬浊液(设pH=13),下列说法正确的是( )
| A、保持温度一定,向该浊液中加入适量的生石灰,溶液pH>13 |
| B、保持温度一定,向该浊液中加入适量的生石灰,溶液Ca2+数目减小 |
| C、向浊液中加入适量的Na2CO3或NH4Cl溶液,都会使溶液变得澄清 |
| D、将浊液加热蒸发掉一部分水,或加入pH=12的烧碱溶液,都能使浊液中固体的质量增大 |
 在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )
在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )| A、平衡时N的转化率为50% |
| B、当温度升高后,则图中θ>450 |
| C、若再加入N,则正、逆反应速率均逐渐增大 |
| D、若在加入N,则反应体系中气体密度减小 |
最近上市的苹果NeW采用了新型锂离子电池,该电池以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质,充、放电的总反应式可表示为Li2FeSiO4
Li+LiFeSiO4,下列说法中不正确的是( )
| 充电 |
| 放电 |
| A、放电时,电池是将化学能转化为电能 |
| B、放电时,正极反应式:LiFeSiO4+Li++e-═Li2SiO4 |
| C、充电时,毎生成1molLiFeSiO4转移2mol电子 |
| D、充电时,Li+向阴极移动 |
锌锰干电池是生活中应用最广泛的电池,下列说法中不正确的是( )
| A、该电池正极反应式为:MnO2+H2O+e-=MnOOH+OH- |
| B、电池工作时负极pH一定降低 |
| C、用该电池作电源精炼铜,纯铜与锌连接 |
| D、用该电池作电源电解硫酸铜溶液,负极溶解6.5g锌,阴极一定析出6.4g铜 |
常温下,下列三个反应均能发生:X2+2W2+═2X-+2W3+;Z2+2X-═2Z-+X2;2W3++2Y-═2W2++Y2.则在相同条件下,下列三个反应:①Y2+2X-═2Y-+X2;②Z2+2Y-═2Z-+Y2;③2W3++2Z-═2W2++Z2也能发生的是( )
| A、只有① | B、只有② |
| C、①和② | D、②和③ |
下列叙述正确的是( )
| A、足量的硫单质与64g铜反应,有2mol电子发生转移 |
| B、常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Kap(AgCl)增大 |
| C、0.1mol?L-1Na2CO3中加入少量NaOH固体振荡,c(Na+)和c(CO32-)都增大 |
| D、相同浓度的CH2COOH和CH2COONa溶液等体积混合后,则:c(CH2COO-)+c(CH2COOH)=c(Na+) |
 亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂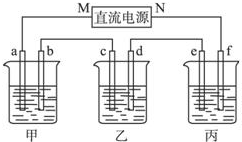 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: