题目内容
12.区别硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”--《本草经集注》,这里运用了硝石的哪些性质( )| A. | 焰色反应 | B. | 氧化性 | C. | 还原性 | D. | 不稳定性 |
分析 不同金属元素在灼烧时产生不同的焰色,利用焰色反应可以鉴别物质所含金属元素,注意焰色反应为元素的性质,属于物理变化,据此解答.
解答 解:鉴别KNO3和Na2SO4,利用钾元素和钠元素的焰色反应不同,钠元素焰色反应为黄色,钾元素焰色反应为隔着钴玻璃为紫色,
故选:A.
点评 本题考查了焰色反应,明确焰色反应原理,熟悉焰色反应的用途是解题关键,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
2.已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
3.在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A、1mol B,发生反应:2A(g)+B(g)?3C(g)△H=-Q kJ/mol(Q>0).经过60s达到平衡,测得B的物质的量为0.4mol,下列对该平衡的叙述正确的是( )
| A. | 用C表示该反应的速率为0.03mol/(L•s) | |
| B. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| C. | 若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变 | |
| D. | 若升高温度,则V (逆)增大,V(正)减小,平衡逆向移动 |
7.下列状态的物质,既能导电又属于电解质的是( )
| A. | 液态氯化氢 | B. | NaCl晶体 | C. | 熔融的KNO3 | D. | CuSO4溶液 |
4.下面是几种常见的化学电源,其中属于一次电池的是( )
| A. | 干电池 | B. | 铅蓄电池 | C. | 燃料电池 | D. | 锂离子电池 |
1.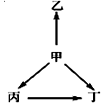 下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
 下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | H2SO4 | |
| B | N2 | NH3 | NO | NO2 | |
| C | CuO | Cu | Cu(OH)2 | CuCl2 | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
7.已知常温下:KSP (AgCl)=1.8×10-10 mol2•L-2,KSP (Ag2CrO4)=1.9×10-12 mol2•L-2,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP (AgCl)<KSP (AgBr) | |
| C. | 将0.001 mol•L- 1 的AgNO3 溶液滴入0.001 mol•L- 1 的KCl和0.001 mol•L- 1 的K2CrO4 溶液中先产生Ag2CrO4 沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
 常见无机物A、B、C、D存在如图转化关系:
常见无机物A、B、C、D存在如图转化关系: