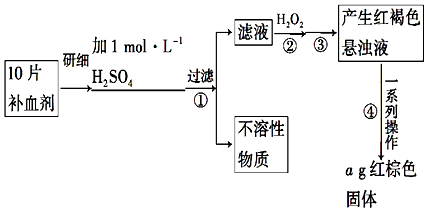
题目内容
4.依据事实,写出反应(1)(2)(3)的热化学方程式,写出反应(4)燃烧热的热化学方程式.(1)0.5mol N2(气态)与H2(气态)反应,生成NH3(气态)放出46.1kJ的热量.
(2)2mol N2(气态)与O2(气态)反应,生成NO(气态)吸收136kJ的热量.
(3)卫星发射可用肼(N2H4)作燃料,2mol N2 H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(液态)放出1244kJ的热量.
(4)汽油的重要成分是辛烷(C8 H18),0.5mol C8 H18(液态)在O2中充分燃烧,放出2759kJ的热量.
分析 (1)根据N2(g)与H2(g)反应生成1mol NH3(g),放出46.1KJ热量,则1molN2(g)与3molH2(g)反应生成2mol NH3(g),放出46.1×2KJ热量,据此书写;
(2)热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比;
(3)2mol N2 H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(液态)放出1244kJ的热量,则1 mol N2H4 在O 2 中燃烧生成N2 (g)和H2O(l)时,放出622 kJ热量,可知焓变为负,结合物质的状态书写热化学方程式,以此来解答;
(4)0.5mol C8 H18(液态)在O2中充分燃烧,放出2759kJ的热量,则1mol C8 H18(液态)在O2中充分燃烧,放出5518kJ的热量,据此书写.
解答 解:(1)因为N2(g)与H2(g)反应生成1mol NH3(g),放出46.1KJ热量,则1molN2(g)与3molH2(g)反应生成2mol NH3(g),放出46.1×2KJ热量,所以反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1,
答:热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1;
(2)2mol N2(气态)与O2(气态)反应,生成NO(气态)吸收136kJ的热量,则1mol N2 (g)与适量O2(g)起反应,生成NO(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1,
答:热化学方程式为N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1;
(3)2mol N2 H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(液态)放出1244kJ的热量,则1 mol N2H4 在O 2 中燃烧生成N2 (g)和H2O(g)时,放出622 kJ热量,故热化学方程式为N2H4(l)+O2(g)=N2 (g)+2H2O(l)△H=-622kJ/mol,
答:热化学方程式为N2H4(l)+O2(g)=N2 (g)+2H2O(l)△H=-622kJ/mol;
(4)0.5mol C8 H18(液态)在O2中充分燃烧,放出2759kJ的热量,则1mol C8 H18(液态)在O2中充分燃烧,放出5518kJ的热量,故热化学方程式为
C8H18(g)+$\frac{25}{2}$O2(g)=8CO2(g)+9 H2O(l)△H=-5518 kJ/mol,
答:燃烧热方程式为C8H18(g)+$\frac{25}{2}$O2(g)=8CO2(g)+9 H2O(l)△H=-5518 kJ/mol.
点评 本题考查了热化学方程式的书写,题目难度中等,注意掌握盖斯定律的应用和热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案| A. | 先褪色,后复原 | B. | 立即褪色 | C. | 仍为紫色 | D. | 溶液变红色 |
| A. | v(NH3)=0.01 mol•L-1•s-1 | B. | v(O2)=0.001 mol•L-1•s-1 | ||
| C. | v(NO)=0.001 mol•L-1•s-1 | D. | v(H2O)=0.045 mol•L-1•s-1 |
| A. | 地沟油经过处理,可用来制造肥皂 | |
| B. | 向食品中添加抗氧化剂(维C)可以对食物起到防腐作用 | |
| C. | 我国的汽油标准已由“国Ⅲ”提高到国“Ⅳ”,这意味着汽车不再排放氮氧化合物 | |
| D. | CO2和CH4都是产生温室效应的气体 |
| A. | 酸式滴定管可以用来装所有的酸或酸性溶液 | |
| B. | 灼烧Na2CO3•10H2O 晶体时应选用耐高温的石英坩埚 | |
| C. | 实验室制取乙酸乙酯时用饱和NaHCO3溶液收集产物 | |
| D. | 测定溶液的pH时,在玻璃板上放一片干燥的pH试纸,用玻璃棒蘸取取待试液滴到pH试纸上,把试纸与标准比色卡比较,读出溶液的pH |
| A. | 组成苯的元素有2种 | B. | 组成聚乙烯的元素有3种 | ||
| C. | 组成葡萄糖的元素有3种 | D. | 组成果糖的元素有3种 |

 ,B的结构简式是
,B的结构简式是 .
. .
.