题目内容
17.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是( )| A. | Ag+、NO3-、Cl-、K+ | B. | K+、Ba2+、OH-、SO42- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Cu2+、NH4+、Cl-、OH- |
分析 具有还原性的离子与具有氧化性的离子,发生氧化还原反应不能共存,以此来解答.
解答 解:A.Ag+、Cl-结合生成沉淀,因复分解反应不能共存,故A不选;
B.Ba2+、SO42-结合生成沉淀,因复分解反应不能共存,故B不选;
C.H+、NO3-、Fe2+发生氧化还原反应,不能共存,故C选;
D.Cu2+、NH4+分别与OH-结合生成沉淀、弱电解质,因复分解反应不能共存,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的性质为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
7.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-→ClO-+Cl-+H2O | |
| B. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-→Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:H++ClO-→HClO |
2.已知某300mLMgCl2与AlCl3的混合液,往其中滴加NaOH溶液,要使沉淀达到最大值,需消耗0.5mol/L的NaOH溶液600mol;则原混合液中c(Cl-)是( )
| A. | 0.5mol/L | B. | 0.8mol/L | C. | 1.0mol/L | D. | 1.5mol/L |
9.在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
下列说法正确的是( )
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T2时,NO2的平衡转化率为70.0% | |
| B. | 该反应的△H>0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 |
6.下列类比关系正确的是( )
| A. | AlCl3与过量NaOH溶液反应生成AlO${\;}_{2}^{-}$,则与过量NH3•H2O也生成AlO${\;}_{2}^{-}$ | |
| B. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 |




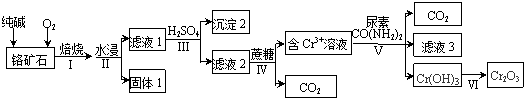
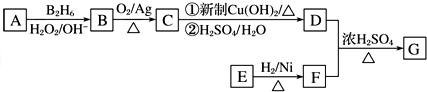
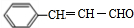 .
.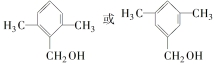 .
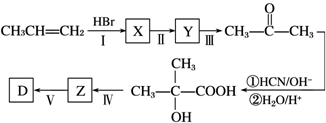
.
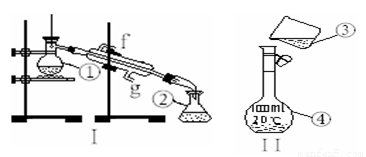
 出下列仪器的名称:① ②
出下列仪器的名称:① ②