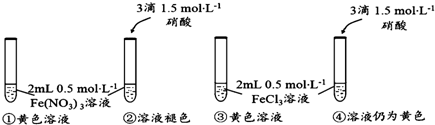
题目内容
5.以某铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为原料生产Cr2O3的流程如下: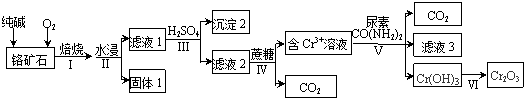
已知:Cr2O72-+H2O?2CrO42-+2H+,Ksp[Cr(OH)3]=6.4×10-31,lg2=0.3
(1)步骤Ⅰ中为了提高反应速率应该采取的措施有适当升温、粉碎铬矿石.(写2种)
(2)滤液1中的阴离子除CO32-外,主要还有CrO42-、SiO32-.
(3)步骤Ⅳ发生的反应中Cr2O72-和蔗糖(C12H22O11)的物质的量之比为8:1.
(4)步骤Ⅴ中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10-5mol•L-1],pH至少调至5.6.
(5)滤液3的主要溶质是两种盐,化学式为(NH4)2SO4、Na2SO4.
(6)研究发现,固态Na2CrO4与氨气在500℃下反应得到NaCrO2,将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3.则NaCrO2溶液与过量CO2反应的离子方程式为CrO2-+CO2+2H2O=Cr(OH)3↓+HCO3-.
分析 以铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应,二氧化硅能与碳酸钠反应生成硅酸钠,FeO被氧化为氧化铁,水浸过滤分离,结合滤液2与蔗糖得到Cr3+、信息Cr2O72-+H2O?2CrO42-+2H+,可知滤液1中含有Na2CrO4、Na2SiO3、未反应的Na2CO3,过滤得到滤渣为氧化铁,调节溶液pH使硅酸根转化为硅酸沉淀,再过滤除去,得到滤液2中含有Na2Cr2O7、Na2SO4,用蔗糖还原,再与尿素反应,滤液3的主要溶质是两种盐为(NH4)2SO4、Na2SO4.
(1)增大接触面积,升高温度等可以反应速率;
(2)滤液1中含有Na2CrO4、Na2SiO3、Na2CO3等;
(3)根据电子转移守恒计算Cr2O72-和蔗糖的物质的量之比;
(4)Cr3+沉淀完全的浓度为10-5mol/L,根据KSP[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.4×10-31计算c(OH-),根据水的离子积计算c(H+),再根据pH=-lgc(H+)计算;
(5)滤液3的主要溶质是两种盐是硫酸铵与硫酸钠;
(6)将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3,属于水解反应,还生成碳酸氢钠.
解答 解:以铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应,二氧化硅能与碳酸钠反应生成硅酸钠,FeO被氧化为氧化铁,水浸过滤分离,结合滤液2与蔗糖得到Cr3+、信息Cr2O72-+H2O?2CrO42-+2H+,可知滤液1中含有Na2CrO4、Na2SiO3、未反应的Na2CO3,过滤得到滤渣为氧化铁,调节溶液pH使硅酸根转化为硅酸沉淀,再过滤除去,得到滤液2中含有Na2Cr2O7、Na2SO4,用蔗糖还原,再与尿素反应,滤液3的主要溶质是两种盐为(NH4)2SO4、Na2SO4.
(1)适当升温、粉碎铬矿石、搅拌等等可以反应速率,
故答案为:适当升温、粉碎铬矿石、搅拌等;
(2)滤液1中含有Na2CrO4、Na2SiO3、Na2CO3等,除CO32-外,主要还有:CrO42-、SiO32-,
故答案为:CrO42-、SiO32-;
(3)反应中Cr元素化合价由+6价降低为+3价,C元素由0价升高为+4,根据电子转移守恒则:6n(Cr2O72-)=48n(蔗糖),故n(Cr2O72-):n(蔗糖)=8:1
故答案为:8:1;
(4)Cr3+沉淀完全的浓度为10-5mol/L,根据KSP[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.4×10-31,可知c(OH-)=4×10-9mol/L,则c(H+)=$\frac{1{0}^{-14}}{4×1{0}^{-9}}$mol/L=$\frac{1}{4}$×10-5mol/L,则pH=-lg$\frac{1}{4}$×10-5=5.6,
故答案为:5.6;
(5)滤液3的主要溶质是两种盐是(NH4)2SO4、Na2SO4,
故答案为:(NH4)2SO4、Na2SO4;
(6)将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3,属于水解反应,还生成碳酸氢钠,反应离子方程式为:CrO2-+CO2+2H2O=Cr(OH)3↓+HCO3-,
故答案为:CrO2-+CO2+2H2O=Cr(OH)3↓+HCO3-.
点评 本题考查物质制备工艺流程,涉及对操作与反应原理的分析评价、物质的分离提纯、溶度积有关计算、化学计算计算等,侧重于学生对原理的分析应用及计算能力的考查,综合性较强,题目难度中等.

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 18O只存在于乙酸分子中 | |
| B. | 18O存在于乙酸和乙酸乙酯中分子中 | |
| C. | 18O只存在于乙醇分子中 | |
| D. | 18O存在于水、乙酸分子中 |
| A. | 铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+ | |
| B. | 硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- | |
| C. | 氯水具有漂白性:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ |
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | X分别与Z、W形成化合物的熔点:Z<W | D. | 简单离子的还原性:X<W |
| A. | Ag+、NO3-、Cl-、K+ | B. | K+、Ba2+、OH-、SO42- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Cu2+、NH4+、Cl-、OH- |
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 单质硅是将太阳能转变为电能的常用材料 |
| A. | 0.1mol•L-1KAl(SO4)2溶液中含0.2NA个SO42- | |
| B. | 常温下,9gH2O含NA个O-H键 | |
| C. | 同温同压同体积的CO2、SO2所含氧原子数均为2NA | |
| D. | 32gCu与S完全反应转移的电子数为NA |