题目内容
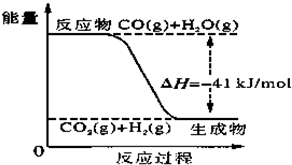 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.(1)增加H2O(g)的浓度,CO的转化率将
(2)平衡常数的表达式K=
(3)已知2H2(g)+O2(g)?2H2O(g)△H=-484kJ/mol.结合上图写出CO完全燃烧生成CO2的热化学方程式:
考点:反应热和焓变,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,从图上可见反应放热,降温平衡正向移动,K增大;
(3)利用盖斯定律,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,从图上可见反应放热,降温平衡正向移动,K增大;
(3)利用盖斯定律,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.
解答:
解:(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大,故答案为:增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,所以,K=
;从图上可见反应放热,降温平衡正向移动,K增大,故答案为:
;>;
(3)已知:①CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41KJ/mol
②2H2(g)+O2(g)?2H2O(g)△H=-484kJ/mol
据盖斯定律①×2+②得:2CO(g)+O2(g)?2CO2(g)△H=-566KJ/mol
故答案为:2CO(g)+O2(g)?2CO2(g)△H=-566KJ/mol.
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,所以,K=
| [CO2]?[H2] |
| [CO]?[H2O] |
| [CO2]?[H2] |
| [CO]?[H2O] |
(3)已知:①CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41KJ/mol
②2H2(g)+O2(g)?2H2O(g)△H=-484kJ/mol
据盖斯定律①×2+②得:2CO(g)+O2(g)?2CO2(g)△H=-566KJ/mol
故答案为:2CO(g)+O2(g)?2CO2(g)△H=-566KJ/mol.
点评:本题考查平衡移动对反应物转化率的影响,以及化学平衡常数的求算和盖斯定律的应用,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
顺丁橡胶常用来制作轮胎的外胎、输送带及胶管,因为( )
| A、顺丁橡胶耐磨性、弹性、耐低温和耐热性都好 |
| B、顺丁橡胶的耐热性好 |
| C、顺丁橡胶的柔韧性好 |
| D、顺丁橡胶的吸水性好 |
在xR2++yH++O2=mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是( )
| A、m=4 R2+是氧化产物 |
| B、m=y R3+是氧化产物 |
| C、m=2 R3+是还原产物 |
| D、m=y R3+是还原产物 |
下列变化属于化学变化的是( )
| A、石油分馏 | B、碘片升华 |
| C、煤的干馏 | D、蔗糖溶于水 |
W、X、Y、Z四种元素是原子序数依次增大的短周期元素,已知:(1)四种元素的电子层数之和等于10,且它们分属于连续的四个主族;(2)四种元素的原子中半径最大的是X原子.下列说法正确的是( )
| A、W和X位于第二周期 |
| B、Y和Z分别是Al和Si |
| C、W和X分别是O和F |
| D、Z的金属性可能比X的金属性强 |
 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
 给你提供纯锌、纯铜片和500ml 0.2mol/L的H2SO4溶液、导线、1000ml量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500ml 0.2mol/L的H2SO4溶液、导线、1000ml量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.