题目内容
在恒容的各个密闭容器中,下列反应分别达到平衡后,有关说法正确的是( )
| A、2HI(g) H2?(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大 |
| B、2NO2(g)?N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅 |
| C、3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加 |
| D、2SO2(g)+O2(g)?2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、该反应正反应是吸热反应,降低温度,平衡向正反应移动,反应前后气体的物质的量不变,体积不变,温度降低,结合pV=nRT判断压强;
B、容器的容积不变,充入氩气,反应混合物各组分的浓度不变,平衡不移动;
C、改变固体的用量,不影响平衡移动;
D、该反应正反应是放热反应,升高温度,平衡向逆反应移动,反应混合气体总的物质的量增大,总质量不变,据此判断;
B、容器的容积不变,充入氩气,反应混合物各组分的浓度不变,平衡不移动;
C、改变固体的用量,不影响平衡移动;
D、该反应正反应是放热反应,升高温度,平衡向逆反应移动,反应混合气体总的物质的量增大,总质量不变,据此判断;
解答:
解:A、该反应正反应是吸热反应,降低温度,平衡向正反应移动,I2的浓度增大,颜色加深,反应前后气体的物质的量不变,容器的体积不变,温度降低,压强降低,故A错误;
B、容器的容积不变,充入氩气,反应混合物各组分的浓度不变,平衡不移动,混合气体的颜色不变化,故B错误;
C、铁是固体,改变铁的用量,不影响平衡移动,故C错误;
D、该反应正反应是放热反应,升高温度,平衡向逆反应移动,反应混合气体总的物质的量增大,总质量不变,平衡摩尔质量减小,故平均相对分子质量减小,故D正确;
故选D.
B、容器的容积不变,充入氩气,反应混合物各组分的浓度不变,平衡不移动,混合气体的颜色不变化,故B错误;
C、铁是固体,改变铁的用量,不影响平衡移动,故C错误;
D、该反应正反应是放热反应,升高温度,平衡向逆反应移动,反应混合气体总的物质的量增大,总质量不变,平衡摩尔质量减小,故平均相对分子质量减小,故D正确;
故选D.
点评:本题考查化学平衡的影响因素,难度不大,注意A选项中温度降低,气体的物质的量不变、体积不变,故压强降低,不能认为压强不变.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
在xR2++yH++O2=mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是( )
| A、m=4 R2+是氧化产物 |
| B、m=y R3+是氧化产物 |
| C、m=2 R3+是还原产物 |
| D、m=y R3+是还原产物 |
下列变化属于化学变化的是( )
| A、石油分馏 | B、碘片升华 |
| C、煤的干馏 | D、蔗糖溶于水 |
下列反应的能量变化与其他三项不相同的是( )
| A、铝粉与氧化铁的反应 |
| B、氯化铵与氢氧化钡的反应 |
| C、锌片与稀硫酸反应 |
| D、钠与冷水反应 |
对于下列事实的解释错误的是( )
| A、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
| D、浓硝酸试剂瓶口常有白雾,说明浓硝酸有挥发性 |
下列有关0.4mol?L-1 BaCl2溶液的说法不正确的是( )
| A、500mL溶液中Ba2+离子浓度为0.4mol?L-1 |
| B、500mL溶液中Cl-离子浓度为0.4mol?L-1 |
| C、500mL溶液中Cl-离子总数为0.4NA |
| D、500mL溶液中Ba2+和Cl-离子总数为0.6NA |
W、X、Y、Z四种元素是原子序数依次增大的短周期元素,已知:(1)四种元素的电子层数之和等于10,且它们分属于连续的四个主族;(2)四种元素的原子中半径最大的是X原子.下列说法正确的是( )
| A、W和X位于第二周期 |
| B、Y和Z分别是Al和Si |
| C、W和X分别是O和F |
| D、Z的金属性可能比X的金属性强 |
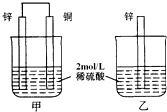 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |