题目内容
下列说法中正确的是( )
| A、基态锂原子的电子排布式是1s22p1 |
| B、离子晶体中可能含共价键 |
| C、熔点:Na2O>I2>SiO2 |
D、H2O2的电子式: |
考点:原子核外电子排布,元素周期律的作用
专题:原子组成与结构专题
分析:A、Li核外有3个电子,分两层排布;
B、离子晶体中一定含有离子键,可能含共价键;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体;
D、H2O2是共价化合物,电子式中不加电荷.
B、离子晶体中一定含有离子键,可能含共价键;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体;
D、H2O2是共价化合物,电子式中不加电荷.
解答:
解:A、Li核外有3个电子,分两层排布,则基态锂原子的电子排布式是1s22s1,故A错误;
B、离子晶体中一定含有离子键,可能含共价键,如NaOH属于离子晶体,含有共价键,故B正确;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体,所以熔点:SiO2>Na2O>I2,故C错误;
D、H2O2是共价化合物,电子式中不加电荷,则其电子式为: ,故D错误;
,故D错误;
故选B.
B、离子晶体中一定含有离子键,可能含共价键,如NaOH属于离子晶体,含有共价键,故B正确;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体,所以熔点:SiO2>Na2O>I2,故C错误;
D、H2O2是共价化合物,电子式中不加电荷,则其电子式为:
 ,故D错误;
,故D错误;故选B.
点评:本题考查了电子排布式、晶体与化学键、不同晶体的熔点比较、电子式,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
相关题目
在xR2++yH++O2=mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是( )
| A、m=4 R2+是氧化产物 |
| B、m=y R3+是氧化产物 |
| C、m=2 R3+是还原产物 |
| D、m=y R3+是还原产物 |
下列有关0.4mol?L-1 BaCl2溶液的说法不正确的是( )
| A、500mL溶液中Ba2+离子浓度为0.4mol?L-1 |
| B、500mL溶液中Cl-离子浓度为0.4mol?L-1 |
| C、500mL溶液中Cl-离子总数为0.4NA |
| D、500mL溶液中Ba2+和Cl-离子总数为0.6NA |
W、X、Y、Z四种元素是原子序数依次增大的短周期元素,已知:(1)四种元素的电子层数之和等于10,且它们分属于连续的四个主族;(2)四种元素的原子中半径最大的是X原子.下列说法正确的是( )
| A、W和X位于第二周期 |
| B、Y和Z分别是Al和Si |
| C、W和X分别是O和F |
| D、Z的金属性可能比X的金属性强 |
有一种高分子材料称为“塑料王”,它的成分是( )
| A、聚乙烯 | B、聚苯乙烯 |
| C、聚四氟乙烯 | D、聚氨酯树脂 |
下列递变规律正确的是( )
| A、KOH、Ca (OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
| B、Na、Mg、Al、Si的金属性逐渐增强 |
| C、HF、HCl、H2S、PH3的稳定性依次增强 |
| D、O、S、Na、K的原子半径依次增大 |
在一定温度下发生可逆反应A(g)+3B(g)?2C(g),下列叙述中,不能判断该反应达到平衡的是
(1)C生成速率与C分解速率相等.
(2)单位时间内生成amolA,同时生成3amolB
(3)A、B、C的浓度不再变化.
(4)单位时间内消耗amolA,同时生成3amolB
(5)A、B、C的分子数之比为1:3:2.
(6)混合气体的物质的量不再变化.( )
(1)C生成速率与C分解速率相等.
(2)单位时间内生成amolA,同时生成3amolB
(3)A、B、C的浓度不再变化.
(4)单位时间内消耗amolA,同时生成3amolB
(5)A、B、C的分子数之比为1:3:2.
(6)混合气体的物质的量不再变化.( )
| A、(2)(5) |
| B、(1)(4)(6) |
| C、(2)(4) |
| D、(3)(4) |
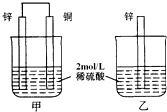 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |