题目内容
10.在实验室进行下列有关实验,理论上正确,操作上可行,经济上合理的是( )| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO,△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2$\stackrel{NaOH溶液}{→}$Cu(OH)2 | |
| C. | Fe$\stackrel{点燃}{→}$Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}}{→}$NaOH溶液 |
分析 A.C在空气中点燃生成CO2而不是CO;
B.Cu和AgNO3反应生成Cu(NO3)2,但AgNO3价格较贵;
C.Fe点燃生成Fe3O4而不是Fe2O3;
D.CaO和水反应生成Ca(OH)2溶液,Ca(OH)2溶液和碳酸钠溶液发生复分解反应生成NaOH.
解答 解:A.空气中氧气含量多,所以C在空气中点燃生成CO2而不是CO且操作过程较麻烦,可以直接用C和CuO制取二氧化碳,故A不选;
B.Cu和AgNO3反应生成Cu(NO3)2,但AgNO3价格较贵,不符合经济特点,故B不选;
C.在纯氧中,Fe点燃生成Fe3O4而不是Fe2O3,故C不选;
D.CaO和水反应生成Ca(OH)2溶液,Ca(OH)2溶液和碳酸钠溶液发生复分解反应生成NaOH,且操作过程简单易行、各药品价格低廉,符合题干要求,故D选;
故选D.
点评 本题考查化学实验方案评价,为高频考点,明确物质性质、物质之间转化是解本题关键,注意题干要求“理论上正确,操作上可行,经济上合理”,很多同学往往漏掉“经济合理”而选B选项,为易错点.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
20. 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.
(1)工业上制备金属钠的常用方法是电解法.试写出制备金属钠的化学方程式2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.金属钠可用于液态钠可作核反应堆的传热介质 (写出Na在熔点低方面的一种用途).
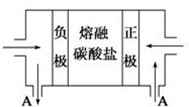
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示:
①正极的电极反应式为O2+4e-+2CO2=2CO32-,电池工作时物质A可循环使用,A物质的化学式为CO2.
②请写出检验Na2CO3中钠元素的方法取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色.
(3)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表:
上述盐溶液的阴离子中,结合H+能力最强的是CO32-,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是c(填序号).
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1mol•L-1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO)>c(SO)>c(OH-)>c(H+).
②已知几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”、“=”或“<”).
 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.(1)工业上制备金属钠的常用方法是电解法.试写出制备金属钠的化学方程式2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.金属钠可用于液态钠可作核反应堆的传热介质 (写出Na在熔点低方面的一种用途).
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示:
①正极的电极反应式为O2+4e-+2CO2=2CO32-,电池工作时物质A可循环使用,A物质的化学式为CO2.
②请写出检验Na2CO3中钠元素的方法取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色.
(3)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
| pH | 8.8 | 9.7 | .6 | 0.3 | 11.1 |
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1mol•L-1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO)>c(SO)>c(OH-)>c(H+).
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
1.下列叙述中,正确的是( )
| A. | 含金属元素的离子一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 金属阳离子被还原不一定得到金属单质 | |
| D. | 某元素从化合态变为游离态时,该元素一定被还原 |
18. 如图所示,将少量试剂a滴入试剂瓶b中,下列实验现象描述正确的是( )
如图所示,将少量试剂a滴入试剂瓶b中,下列实验现象描述正确的是( )
 如图所示,将少量试剂a滴入试剂瓶b中,下列实验现象描述正确的是( )
如图所示,将少量试剂a滴入试剂瓶b中,下列实验现象描述正确的是( )| 选项 | 试剂a | 试剂b | 预测实验现象 |
| A | 浓盐酸 | 二氧化锰 | 产生大量黄绿色气体 |
| B | 烧碱溶液 | 明矾溶液 | 先生成白色沉淀,后溶解 |
| C | 浓硝酸 | 铝片 | 铝片溶解,产生大量红棕色气体 |
| D | 稀硫酸 | 含KSCN的硝酸亚铁溶液 | 溶液变红色,溶液中产生气泡 |
| A. | A | B. | B | C. | C | D. | D |
5.2015年9月18日,美国环保署EPA宣布,大众汽车公司利用软件隐瞒了汽车有毒污染物的真实排放量,汽车尾气中的污染物有固体悬浮微粒、一氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等.下列有关说法中正确的是( )
| A. | 一氧化碳、氮氧化物是酸雨形成的主要因素 | |
| B. | 汽车尾气可通过净化装置将碳氢化合物还原成CO2和H2O | |
| C. | 含铅化合物导致人体蛋白质变性是物理变化 | |
| D. | 固体悬浮微粒是造成雾霾天气的一种重要因素 |
15.下列实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 在ZnS的白色浊液中滴几滴CuSO4溶液 | 探究Ksp(ZnS)和Ksp(CuS)的相对大小 |
| B | 用pH试纸分别测定等浓度的NaF、NaClO溶液的pH | 探究HF与HClO的电离常数 |
| C | 取少量硝酸亚铁溶液,滴加盐酸和KSCN溶液 | 探究硝酸亚铁是否变质 |
| D | 在CH2=CHCH2OH中滴加酸性高锰酸钾溶液,振荡 | 检验丙烯醇是否具有碳碳双键 |
| A. | A | B. | B | C. | C | D. | D |
2.化合物 所含官能团有( )
所含官能团有( )
 所含官能团有( )
所含官能团有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
19.下列物质中不含非极性共价键的是( )
①Na2O2 ②CCl4 ③HCN ④CH2=CH2 ⑤CH3COOH ⑥NaOH.
①Na2O2 ②CCl4 ③HCN ④CH2=CH2 ⑤CH3COOH ⑥NaOH.
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤ |
1.下列有机物命名正确的是( )
| A. | CH3-CH═CH-CH3 二丁烯 | B. | 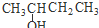 2-羟基丁烷 2-羟基丁烷 | ||
| C. | CH3OOCC2H5 乙酸乙酯 | D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |