题目内容
2.氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(ClO3)2•6H2O的流程如图1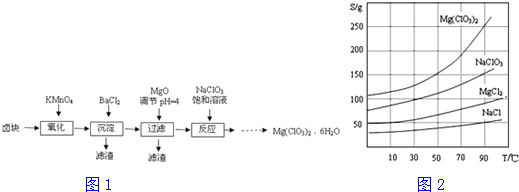
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质.
②四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
(1)过滤所需要的主要玻璃仪器有漏斗、玻璃棒、烧杯.
(2)加MgO后过滤所得滤渣的主要成分的化学式为Fe(OH)3.
(3)加入NaClO3饱和溶液后发生反应的化学方程式为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发结晶;②趁热过滤;洗涤;③将滤液冷却结晶;④过滤、洗涤.
(4)产品中Mg(ClO3)2•6H2O含量的测定:(已知Mg(ClO3)2•6H2O的摩尔质量为299g/mol)
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000mol•L-1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点.反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
①写出步骤2中发生反应的离子方程式ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②产品中Mg(ClO3)2•6H2O的质量分数为78.3%.(保留到小数点后一位)
分析 卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入高锰酸钾之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,滤渣有BaSO4和Fe(OH)3,根据溶解度曲线可知,混合溶液中NaCl溶解度最小,再加入NaClO3饱和溶液得到NaCl沉淀与Mg(ClO3)2溶液,经过蒸发浓缩、趁热过滤、冷却结晶、洗涤、干燥得到Mg(ClO3)2•6H2O.
(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等;
(2)加入MgO的作用是调节溶液的pH,使杂质Fe3+形成沉淀完全除去;
(3)向滤液中加入NaClO3饱和溶液后,发生反应MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,然后利用NaCl、Mg(ClO3)2的溶解度与温度的关系,将溶液蒸发结晶、趁热过滤、洗涤,得到Mg(ClO3)2•6H2O;
(4)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;
②根据化学反应ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,根据各个质物之间的关系式可计算百分含量.
解答 解:(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,
故答案为:漏斗、玻璃棒、烧杯;
(2)加入MgO的作用是调节溶液的pH=4,可以促进铁离子的水解,使杂质Fe3+形成沉淀完全除去,所以加MgO后过滤所得滤渣的主要成分的化学式为Fe(OH)3,故答案为:Fe(OH)3;
(3)向滤液中加入NaClO3饱和溶液后,发生反应:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,然后利用NaCl、Mg(ClO3)2的溶解度与温度的关系将溶液蒸发结晶、趁热过滤、洗涤,就得到Mg(ClO3)2•6H2O,
故答案为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓;趁热过滤;
(4)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:$\frac{1}{6}$×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:($\frac{1}{2}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.3%.
故答案为:78.3%.
点评 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度中等.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案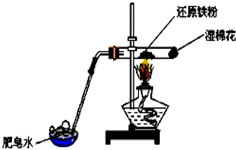
| A. | 实验时,试管口应高于试管底 | |
| B. | 加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声 | |
| C. | 反应的化学方程式为:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2 | |
| D. | 实验结束后如果固体仍为黑色,说明原反应没有发生 |
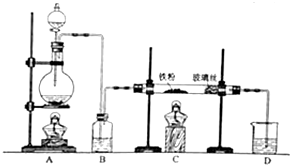
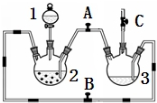 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.(1)稀硫酸应放在分液漏斗中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B、打开开关AC就可观察到氢氧化亚铁的颜色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是将铁粉换成铁块或铁钉.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体 (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次来 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色
通过实验数据计算的该产品纯度为$\frac{980c}{a}$×100%(用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是BC
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
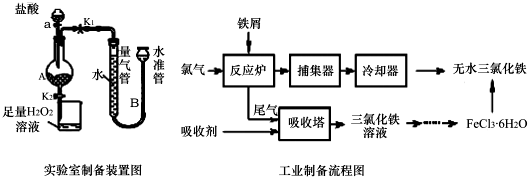
已知:(1)无水FeCl3熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是把亚铁离子全部氧化成三价铁离子.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变.
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 盐酸后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为Fe2Cl6.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
样品中氯化铁的质量分数$\frac{162.5cV}{m}$%.
| A. | 已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,混合溶液中当c(H+)=$\sqrt{{k}_{W}}$ mol•L-1时可判定该溶液呈中性 | |
| B. | pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c(H+)与c(SO42-)的比为2:1 | |
| C. | 某温度下,水的离子积常数Kw=10-12,该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为9:1 | |
| D. | 将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为11:1 |
| A. | 甲烷在O2中燃烧的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与H2O(g)反应 | D. | 铝片与稀H2SO4反应 |

 回答下列问题:
回答下列问题: