题目内容
14.海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: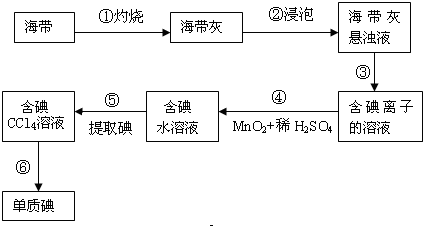
(1)步骤②的实验操作选用仪器的名称是烧杯、玻璃棒;步骤⑥的目的是从含碘CCl4溶液中分离出单质碘和回收CCl4,该步骤的实验操作名称是蒸馏.
(2)步骤⑤中选择用CCl4而不用酒精来提取碘的理由是酒精溶于水而CCl4不溶于水.
(3)步骤④所涉及反应的化学方程式为:MnO2+2KI+2H2SO4═MnSO4+K2SO4+2H2O+I2请在上述反应中用双线桥标出电子转移方向和数目,并请写出该反应的离子方程式MnO2+2I-+4H+═Mn2++2H2O+I2.
分析 海带在坩埚中灼烧,海带灰浸泡后,过量除去杂质,含碘离子溶液加入二氧化锰,在酸性条件下发生氧化还原反应生成碘,⑤为萃取操作,用于分离碘,含碘苯溶液蒸馏可得到碘,以此解答该题.
解答 解:(1)步骤②的实验操作用于溶解固体药品,选用仪器的名称是烧杯、玻璃棒,步骤⑥的目的是从含碘CCl4溶液中分离出单质碘和回收CCl4,为蒸馏操作,
故答案为:烧杯、玻璃棒;蒸馏;
(2)步骤⑤为萃取,引用四氯化碳,酒精易溶于水,不能用作萃取剂,故答案为:酒精溶于水而CCl4不溶于水;
(3)反应MnO2+2KI+2H2SO4═MnSO4+K2SO4+2H2O+I2中,Mn元素化合价由+4价降低到+2价,I元素化合价由-1价升高到0价,反应的离子方程式为MnO2+2I-+4H+═Mn2++2H2O+I2,用双线桥标出电子转移方向和数目为 ,
,
故答案为: ;MnO2+2I-+4H+═Mn2++2H2O+I2.
;MnO2+2I-+4H+═Mn2++2H2O+I2.
点评 本题考查海水资源的综合利用,为高频考点,侧重于学生的分析、实验能力的考查,侧重考查物质的检验、混合物的分离和提纯,明确常见混合物分离和提纯方法及其选取方法是解本题关键,难度不大.

练习册系列答案
相关题目
4.下列物质不可能通过化合反应得到的是( )
| A. | Al2S3 | B. | FeCl2 | C. | Fe(OH)3 | D. | H2SiO3 |
2.如表关于纯净物、混合物、电解质、非电解质的组合正确的是( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 小苏打 | 干冰 |
| B | 蒸馏水 | 氨水 | 火碱 | 二氧化硫 |
| C | 硫酸 | 胆矾 | 纯碱 | 氨气 |
| D | 硝酸 | 食盐 | 氢氧化钠溶液 | 生石灰 |
| A. | A | B. | B | C. | C | D. | D |
9.相对分子质量为M的气态化合物V L(标准状况下),溶于m g水中,得到质量分数为w 的溶液,物质的量浓度为c mol/L,密度为d g/mL,则下列说法不正确的是( )
| A. | 相对分子质量 M=$\frac{22.4mw}{[(1-w)V]}$ | B. | 物质的量浓度 c=$\frac{1000dV}{(MV+22.4m)}$ | ||
| C. | 溶质的质量分数 w=$\frac{MV}{22.4m}$ | D. | 溶液密度 d=$\frac{cM}{1000w}$ |
19.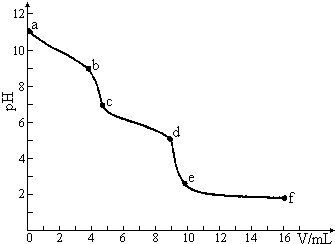 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)=c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
6.下列物质中,属于强电解质的是( )
| A. | NH4Cl | B. | HCOOH | C. | NH3•H2O | D. | Al(OH)3 |