题目内容
3.一定温度下,在一固定体积的密闭容器中,能判断可逆反应A(s)+3B(g)?2C(g)达到平衡状态的有( )①C的生成速率和C的分解速率相等
②容器中C的体积分数不变
③气体密度不再变化
④混合气体的总压强不再变化
⑤A、B、C物质的量之比为1:3:2
⑥混合气体的平均相对分子质量不变
⑦单位时间内生成a mol A,同时生成3a mol B.
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①C的生成速率和C的分解速率相等,正逆反应速率相等,达平衡状态,故正确;
②容器中C的体积分数不变,正逆反应速率相等,达平衡状态,故正确;
③气体密度不再变化,说明气体的质量不变,达平衡状态,故正确;
④混合气体的总压强不再变化,说明气体的物质的量不变,反应达平衡状态,故正确;
⑤当体系达平衡状态时,A、B、C物质的量之比可能为1:3:2,也可能不是1:3:2,与各物质的初始浓度及转化率有关,故错误;
⑥混合气体的平均相对分子质量不变,说明气体的质量和物质的量不变,反应达平衡状态,故正确;
⑦单位时间内生成a mol A,同时生成3a mol B,都反映的逆反应方向,故错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
11.下列事实一定能证明HF是弱酸的是 ( )
①常温下NaF溶液的pH大于7;
②1mol/L HF溶液能使紫色石蕊试液变红;
③HF与NaCl不能发生反应;
④常温下0.1mol/LHF溶液的pH为2.3;
⑤HF能与Na2CO3溶液反应产生CO2;
⑥HF与水能以任意比混溶.
①常温下NaF溶液的pH大于7;
②1mol/L HF溶液能使紫色石蕊试液变红;
③HF与NaCl不能发生反应;
④常温下0.1mol/LHF溶液的pH为2.3;
⑤HF能与Na2CO3溶液反应产生CO2;
⑥HF与水能以任意比混溶.
| A. | ①② | B. | ①④ | C. | ③④⑥ | D. | ②③⑤ |
8.实验室进行NaCl溶液蒸发实验时,一般有以下操作过程:①放置酒精灯;②固定铁圈位置;③放上蒸发皿;④加热搅拌;⑤停止加热,余热蒸干.其正确的操作顺序为( )
| A. | ②③④⑤① | B. | ②③①④⑤ | C. | ①②③④⑤ | D. | ②①③④⑤ |

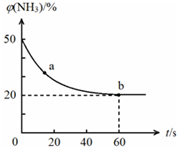 合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.
合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.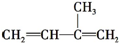 )是一种重要的二烯烃,它是天然橡胶的单体.
)是一种重要的二烯烃,它是天然橡胶的单体.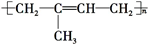 .
.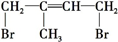 、
、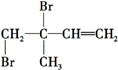 、
、