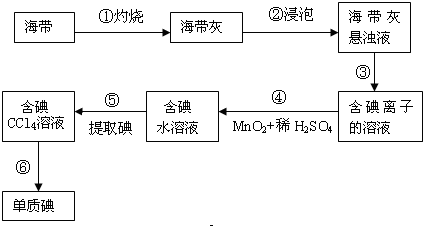
题目内容
5.按要求完成有关反应的离子反应方程式:(1)实验室制取氯气MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)氢氧化镁溶于盐酸Mg(OH)2+2H+=Mg2++2H2O.
(3)过氧化钠溶于水2Na2O2+2H2O=4Na++4OH-+O2↑.
分析 (1)实验室制备氯气是利用二氧化锰固体和浓盐酸加热反应生成氯化锰、氯气和水;
(2)氢氧化镁与盐酸反应生成氯化镁和水,氢氧化镁需要保留化学式;
(3)过氧化钠与水反应生成氢氧化钠和氧气.
解答 解:(1)实验室用浓盐酸与二氧化锰加热制取氯气,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)氢氧化镁难溶于水,与盐酸发生中和反应,反应的离子方程式为:Mg(OH)2+2H +=Mg2++2H2O,
故答案为:Mg(OH)2+2H +=Mg2++2H2O;
(3)Na2O2和H2O生成NaOH和O2,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,如:难溶物、弱电解质等需要保留化学式,符合守恒关系(如:质量守恒和电荷守恒等)、符合原化学方程式等,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.溴苯是一种化工原料,可以用溴和苯反应合成.实验室合成溴苯的装置示意图如下:

表为苯、溴和溴苯的相关数据,回答下列问题:
在A中加入30.0mL无水苯和少量铁屑.在B中小心加入8.0mL液态溴.向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏.
①A的容积最适合的是c(填编号).
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据C2(填“C1”或“C2”)所显示的温度,其温度应为156℃.
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,则用它可吸收承接到的所有物质有Br2、HBr、C6H6(填化学名称).
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应.
第一步:取少量反应后F装置中的溶液于试管中;
第二步:向其中加入过量的稀硝酸;
第三步:继续滴加少量的硝酸银溶液.如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应.
该实验方案不合理(填“合理”或“不合理”),理由是溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应.

| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在A中加入30.0mL无水苯和少量铁屑.在B中小心加入8.0mL液态溴.向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏.
①A的容积最适合的是c(填编号).
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据C2(填“C1”或“C2”)所显示的温度,其温度应为156℃.
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,则用它可吸收承接到的所有物质有Br2、HBr、C6H6(填化学名称).
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应.
第一步:取少量反应后F装置中的溶液于试管中;
第二步:向其中加入过量的稀硝酸;
第三步:继续滴加少量的硝酸银溶液.如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应.
该实验方案不合理(填“合理”或“不合理”),理由是溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应.
16.下列说法不正确的是( )
| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧热的热化学方程式为:CO (g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0 kJ•mol-1 | |
| B. | 稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ•mol-1,则表示稀硫酸与稀氢氧化钾溶液中和热的热化学方程式为:$\frac{1}{2}$H2SO4(l)+KOH(l)═$\frac{1}{2}$K2SO4(l)+H2O(l);△H=-57.3 kJ•mol-1 | |
| C. | 已知H-H键键能为436 kJ•mol-1,H-N键键能为391 kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1,则N≡N键的键能约为946kJ•mol-1 | |
| D. | 一定条件下,反应2CO(g)═CO2(g)+C(s)可自发进行,则该反应的△H<0 |
20.在100℃时,3.6g CO和H2的混合气体与足量的氧气反应后通入装有足量Na2O2的反应管充分反应,已知CO和H2的质量比为5:1,则反应管增重( )
| A. | 5.6 | B. | 1.6 | C. | 3.2 | D. | 3.6 |
10.下列说法正确的是( )
| A. | HD、CaCl2、NaOH、HCl四种物质都属于化合物 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 金属氧化物不一定是碱性氧化物,非金属氧化物不一定是酸性氧化物 | |
| D. | 金属单质只能做还原剂,非金属单质只能做氧化剂 |

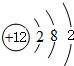 ,B+的离子结构示意图
,B+的离子结构示意图 .
.
 )是一种重要的二烯烃,它是天然橡胶的单体.
)是一种重要的二烯烃,它是天然橡胶的单体. .
. 、
、 、
、