题目内容
6.下列物质中,属于强电解质的是( )| A. | NH4Cl | B. | HCOOH | C. | NH3•H2O | D. | Al(OH)3 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在溶液里全部电离的是强电解质,部分电离属于若电解质,电解质属于纯净物、化合物,据此解答即可.
解答 解:A.氯化铵是盐,属于强电解质,故A正确;
B.甲酸是弱酸,属于弱电解质,故B错误;
C.一水合氨属于弱碱,是弱电解质,故C错误;
D.氢氧化铝属于弱碱,故D错误,
故选A.
点评 本题考查了强弱电解质的判断,把握电解质的定义,分清强弱电解质的本质区别,题目难度不大.

练习册系列答案
相关题目
16.下列说法不正确的是( )
| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧热的热化学方程式为:CO (g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0 kJ•mol-1 | |
| B. | 稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ•mol-1,则表示稀硫酸与稀氢氧化钾溶液中和热的热化学方程式为:$\frac{1}{2}$H2SO4(l)+KOH(l)═$\frac{1}{2}$K2SO4(l)+H2O(l);△H=-57.3 kJ•mol-1 | |
| C. | 已知H-H键键能为436 kJ•mol-1,H-N键键能为391 kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1,则N≡N键的键能约为946kJ•mol-1 | |
| D. | 一定条件下,反应2CO(g)═CO2(g)+C(s)可自发进行,则该反应的△H<0 |
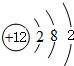 ,B+的离子结构示意图
,B+的离子结构示意图 .
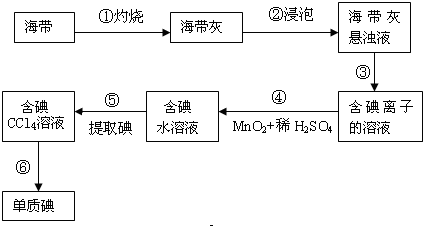
.
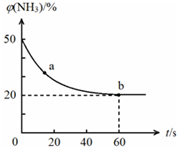 合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.
合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%. )是一种重要的二烯烃,它是天然橡胶的单体.
)是一种重要的二烯烃,它是天然橡胶的单体. .
. 、
、 、
、
