题目内容
8. 汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.
汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.0kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
2C(s)+2O2(g)=2CO2(g)△H=-787.0kJ/mol
则尾气转化反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746kJ/mol.
(2)对于反应2NO(g)+2CO(g)?N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol/L | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
| c(CO)/×10-4mol/L | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
①前2s内的平均反应速率 υ(CO2)=6.25×10-5mol/(L•s).
②在该温度下,反应的平衡常数K=10000.
(3)假设在恒容密闭容器中发生上述反应,下列有关说法正确的是C.
A.选用更有效的催化剂能提高尾气的转化率
B.升高反应体系的温度能提高反应速率,提高尾气的转化率
C.相同温度下,若NO和CO的起始浓度分别为1.50×10-4mol/L和2.00×10-4mol/L,平衡时N2的体积分数比原平衡体系中N2的体积分数低
D.单位时间内消耗NO的物质的量等于生成CO2的物质的量时即达平衡状态
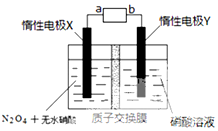
(4)用尾气NO2为原料可制新型硝化剂N2O5,原理:先将NO2转化为N2O4,再采用电解法制备N2O5,装置如图所示则电源b极是负极(填“正”“负”),生成N2O5电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,电解一段时间后硝酸溶液的pH不变(填“增大”“减小”“不变”).
分析 (1)依据热化学方程式和盖斯定律计算所需热化学化学方程式;
(2)①根据化学反应速率的定义及2s内浓度的变化量来计算解答;
②化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(3)A.催化剂不能改变平衡状态;
B.升高反应体系的温度平衡向吸热的方向移动;
C.相同温度下,若NO和CO的起始浓度分别为1.50×10-4mol/L和2.00×10-4mol/L,依据等效平衡比较平衡时N2的体积分数比原平衡体系中N2的体积分数;
D.消耗NO的物质的量等于生成CO2的物质的量,都表示反应正方向,任何反应过程中都满足;
(4)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成.阴极反应式为2H++2e-=H2,所以工作一段时间后,硝酸水溶液的氢离子基本不变即pH不变.
解答 解:已知:①N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol
②2C(s)+O2(g)=2CO(g)△H=-221.0KJ/mol
③2C(s)+2O2(g)=2CO2(g)△H=-787.0kJ/mol
依据盖斯定律③-②-①得到,反应的热化学方程式为:2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=(-787KJ/mol)-(-221.0KJ/mol)-(+180kJ/mol)=-746kJ/mol;
故答案为:-746kJ/mol;
(2)①由表格中的数据可知2s内NO浓度的变化量为3.00×10-4-1.75×10-4=1.25×10-4mol/L,2NO(g)+2CO(g)?N2(g)+2CO2(g),则前2s内CO2浓度的变化量为1.25×10-4mol/L,化学反应速率V(CO2)=$\frac{△c}{△t}$=$\frac{1.25×1{0}^{-4}mol/L}{2s}$=6.25×10-5 mol/(L•S),
故答案为:6.25×10-5;
②分析图表数据,依据化学平衡三段式列式计算平衡浓度:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol/L) 3×10-4 4×10-4 0 0
变化量(mol/L) 2×10-4 2×10-4 1×10-4 2×10-4
平衡量(mol/L) 1×10-4 2×10-41×10-4 2×10-4
该反应的化学平衡常数表达式为K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(CO){c}^{2}(NO)}$=$\frac{(1×1{0}^{-4})×(2×1{0}^{-4})^{2}}{(2×1{0}^{-4})^{2}×(1×1{0}^{-4})^{2}}$=10000,
故答案为:10000;
(3)A.选用更有效的催化剂,只能改变反应速率,不能改变平衡,故A错误;
B.反应时放热反应,升高反应体系的温度,平衡逆向进行,一氧化氮转化率减小,故B错误;
C.相同温度下,若NO和CO的起始浓度分别为1.50×10-4mol/L和2.00×10-4mol/L,相当于原体系反应物浓度的一半,等效于原反应体积扩大一倍,平衡逆向移动,平衡时N2的体积分数比原平衡体系中N2的体积分数低,故C正确;
D.单位时间内消耗NO的物质的量为V正,生成CO2的物质的量也表示V正,任何反应过程中都满足,故D错误;
故选C;
(4)N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.阴极反应式为2H++2e-=H2,所以工作一段时间后,硝酸水溶液的氢离子基本不变即pH不变;
故答案为:负,N2O4+2HNO3-2e-=2N2O5+2H+,不变.
点评 本题考查了反应热的计算、化学平衡的影响因素分析应用、平衡常数计算等知识,掌握化学平衡移动原理是解题关键,题目难度中等.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案| A. | 在食品中加入着色剂 | B. | 轮船船身装锌块防腐 | ||
| C. | 在糕点包装内放置抗氧化剂 | D. | 燃煤发电时用煤粉代替煤块 |
| A. | 向某溶液中加入稀硝酸酸化,再滴入BaCl2溶液,产生白色沉淀,则原溶液中一定有SO42- | |
| B. | 向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中一定有Cl-? | |
| C. | 用光洁的铂丝蘸取某无色溶液,在酒精灯外焰里灼烧时观察到黄色火焰,则原溶液中一定有Na+ | |
| D. | 向某溶液中加入碳酸钠溶液,产生白色沉淀,再滴入稀盐酸,沉淀溶解,则原溶液中一定有Ca2+ |
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=-1048kJ/mol
(1)上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1,
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态N2O4反应生成液态水时放出的热量是612kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(4)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+2H2O(g)?CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
| A. | H2SO4(浓)$\stackrel{Fe}{→}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO3(s) | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | SiO2$→_{△}^{NaOH(AQ)}$Na2SiO3(aq)$\stackrel{足量CO_{2}}{→}$H2SiO3 | |
| D. | NaAlO2$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$AlCl3(s) |
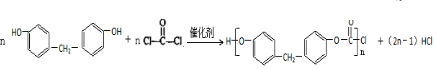
 +H2O
+H2O $\stackrel{H+}{→}$
$\stackrel{H+}{→}$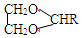 +H2O
+H2O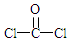 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$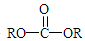 +2HCl
+2HCl .
. .
. .
. .
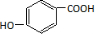
.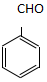 )为原料,选用必要的无机试剂合成
)为原料,选用必要的无机试剂合成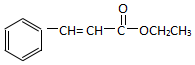 ,写出合成路线
,写出合成路线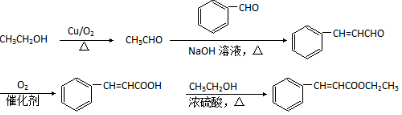 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
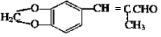
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件). 烯烃A在一定条件下可以按下而的流程进行反应.
烯烃A在一定条件下可以按下而的流程进行反应.
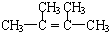 .
.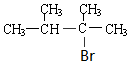 .
.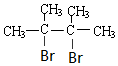 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$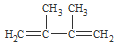 +2NaBr+2H2O.
+2NaBr+2H2O.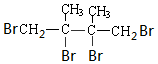 .
.

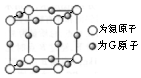 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题:
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题: