题目内容
5.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1mol X在该反应中失去啊3.01×1023个电子.(1)写出该反应的化学方程式:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O;
(2)该反应体系中,若用浓盐酸代替硫酸,用离子方程式表示后果:PbO2+4H++2Cl-═Pb2++Cl2↑+2H2O.
分析 (1)X是一种硫酸盐,且0.2mol X在该反应中失去1mol 电子,即1molX在该反应中失去5mol电子,根据元素守恒知,该元素是锰元素,生成物中锰元素是+7价,则X中锰元素显+2价,所以X是MnSO4,根据氧化还原反应中得失电子数相等配平方程式;
(2)用浓盐酸代替硫酸,反应生成氯化铅、氯气和水.
解答 解:(1)X是一种硫酸盐,且0.1mol X在该反应中失去0.5mol 电子,即1molX在该反应中失去5mol电子,根据元素守恒知,该元素是锰元素,生成物中锰元素是+7价,则X中锰元素显+2价,所以X是MnSO4,根据氧化还原反应中得失电子数相等配平方程式,该反应方程式为:2MnSO4+5PbO2+2H2SO4=Pb(MnO4)2+4PbSO4+2H2O,
故答案为:2MnSO4+5PbO2+2H2SO4=Pb(MnO4)2+4PbSO4+2H2O;
(2)该反应体系中,若用浓盐酸代替硫酸,反应生成氯化铅、氯气和水,用离子方程式表示:PbO2+4H++2Cl-═Pb2++Cl2↑+2H2O;
故答案为:PbO2+4H++2Cl-═Pb2++Cl2↑+2H2O.
点评 本题考查了氧化还原反应方程式的配平,明确发生反应的实质熟悉氧化还原反应得失电子守恒、原子个数守恒规律是解题关键,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
15.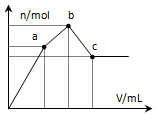 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点的溶液呈中性 | |
| B. | 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ | |
| C. | c点加入Ba(OH)2溶液的体积为200 mL | |
| D. | c点溶液呈碱性 |
16.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1.0mol.L-1的氨水中NH4+、NH3和NH3•H2O的总数为NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 0.1 mol Cu与足量浓硫酸反应生成SO2的体积约为4.48 L | |
| D. | 常温常压下,21g氧气和27 g臭氧所含的氧原子总数为3NA |
13.如图中a、b、c、d、e为周期表前4周期的一部分元素,有关叙述正确的是( )
| a | ||||
| b | ||||
| c | d | |||
| e |
| A. | b元素除0价外,只有一种化合价 | |
| B. | c元素只能形成一种氢化物且很不稳定 | |
| C. | d元素是五种元素中原子半径最小的一种 | |
| D. | e元素最高价氧化物的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐 |
20.化学与人类生产、生活、社会可持续发展密切相关.下列有关说法正确的是( )
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 | |
| D. | 向水中加入明矾进行杀菌消毒 |
10.甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下(反应条件及其它产物已略去).下列说法正确的是( )
甲$→_{①}^{+丁}$乙$→_{②}^{+丁}$丙.
甲$→_{①}^{+丁}$乙$→_{②}^{+丁}$丙.
| A. | 丁一定是氧化剂 | B. | 甲只能是 S 或 N2 | ||
| C. | 乙一定是氧化物 | D. | 反应②可能是非氧化还原反应 |
17.如表是周期表中的一部分,根据A-I在周期表中的位置,第(1)-(4)小题用元素符号或化学式回答,(5)-(6)小题按题目要求回答.
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF
(4)A、B、E、F、G、H中,原子半径顺序是Na>P>Cl>N>F>H
(5)工业上制备C的原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4A1+3O2↑
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF
(4)A、B、E、F、G、H中,原子半径顺序是Na>P>Cl>N>F>H
(5)工业上制备C的原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4A1+3O2↑
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
13.工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如图所示:
有关氢氧化物开始沉淀和沉淀完全的pH如下表;
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是增大接触面积,加快反应速率(使反应更充分).
(2)酸浸后溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Pb2+、Cu2+等,其除杂过程如下:
①加入MnO2的目的是氧化亚铁离子得到铁离子;
②加入CaO将溶液调至pH=5.2~6,所得沉淀的成分为Fe(OH)3、Al(OH)3(填化学式);
③加入BaS除去Cu2+、Pb2+(填化学式)后,再加入NaF除去Ca2+.
(3)已知Ksp(CaF2)=4.0×10-11,计算当溶液中Ca2+完全沉淀[c(Ca2+)<10-5mol/L]后,所得
溶液每m3中至少含F-的质量为38g.
(4)从溶液A中回收的主要物质常用作化肥,该物质水解的离子方程式为NH4++H2O?NH3.H2O+H+.
(5)NH4HCO3溶液中,下列关系式正确的是AC.
A.c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(NH4+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(OH-)+c(NH3•H2O)=c(H+)+c(H2CO3)-c(CO32-)
D.(NH4+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)

有关氢氧化物开始沉淀和沉淀完全的pH如下表;
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 9.8 |
(1)酸浸前将碳酸锰矿粉碎的作用是增大接触面积,加快反应速率(使反应更充分).
(2)酸浸后溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Pb2+、Cu2+等,其除杂过程如下:
①加入MnO2的目的是氧化亚铁离子得到铁离子;
②加入CaO将溶液调至pH=5.2~6,所得沉淀的成分为Fe(OH)3、Al(OH)3(填化学式);
③加入BaS除去Cu2+、Pb2+(填化学式)后,再加入NaF除去Ca2+.
(3)已知Ksp(CaF2)=4.0×10-11,计算当溶液中Ca2+完全沉淀[c(Ca2+)<10-5mol/L]后,所得
溶液每m3中至少含F-的质量为38g.
(4)从溶液A中回收的主要物质常用作化肥,该物质水解的离子方程式为NH4++H2O?NH3.H2O+H+.
(5)NH4HCO3溶液中,下列关系式正确的是AC.
A.c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(NH4+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(OH-)+c(NH3•H2O)=c(H+)+c(H2CO3)-c(CO32-)
D.(NH4+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)