题目内容
16.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1.0mol.L-1的氨水中NH4+、NH3和NH3•H2O的总数为NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 0.1 mol Cu与足量浓硫酸反应生成SO2的体积约为4.48 L | |
| D. | 常温常压下,21g氧气和27 g臭氧所含的氧原子总数为3NA |
分析 A、溶液体积不明确;
B、过氧化钠和水的反应为歧化反应;
C、二氧化硫所处的状态不明确;
D、氧气和臭氧均由氧原子构成.
解答 解:A、溶液体积不明确,故溶液中的NH4+、NH3和NH3•H2O的总数无法计算,故A错误;
B、过氧化钠和水的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故B错误;
C、二氧化硫所处的状态不明确,故生成的二氧化硫的体积无法计算,故C错误;
D、氧气和臭氧均由氧原子构成,故21g氧气和27g臭氧即48g混合物中含有的氧原子的物质的量为3mol,个数为3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.黑火药是我国古代四大发明之一,其爆炸反应:S+2KNO3+3C=K2S+N2↑+3CO2↑.设该反应中转移的电子数为a mol,被2mol KNO3氧化而成的氧化产物为b mol,则a、b的值分别为( )
| A. | 12、2.5 | B. | 24、2.5 | C. | 12、3 | D. | 24、3 |
7.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L.若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
| A. | c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | B. | c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | ||
| C. | c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) | D. | c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
4.甲、乙、丙、丁、是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO${\;}_{3}^{-}$离子中的两种组成,可以发生如图转化,下列说法不正确的是( )
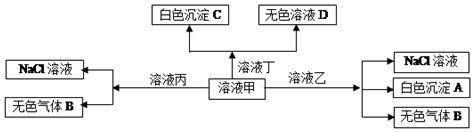

| A. | 在甲中滴加丁开始反应的离子方程式:HCO${\;}_{3}^{-}$+Ba2++OH-=BaCO3↓+H2O | |
| B. | 溶液丙中还可以大量共存的离子有:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 白色沉淀A可能溶解在溶液D中 | |
| D. | 甲为NaHCO3,乙为AlCl3 |
8.下列说法正确的是( )
| A. | pH=12和pH=8的氢氧化钠溶液等体积混合后溶液的pH值为10 | |
| B. | Na2CO3溶液c(Na+)与c(CO32-)之比为2:1 | |
| C. | 0.2 mol•L-1与0.1 mol•L-1醋酸中c(H+)之比为2:1 | |
| D. | NO2溶于水时,氧化产物与还原产物的质量之比为2:1 |
5.实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持和加热设备已省略).

(1)a、b两仪器的名称是:a分液漏斗;b蒸馏烧瓶(.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:MnO2和浓盐酸,相关的化学反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯大于溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.

(1)a、b两仪器的名称是:a分液漏斗;b蒸馏烧瓶(.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:MnO2和浓盐酸,相关的化学反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入c.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.