题目内容
向一定量的Fe、FeO和Fe2O3的混合物中加入120ml 4mol∕L的稀硝酸,恰好使混合物完全溶解,放出2.24LNO(标况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )
| A、0.21mol |
| B、0.24mol |
| C、0.19mol |
| D、0.14mol |
考点:有关混合物反应的计算
专题:
分析:混合物与硝酸反应时恰好使混合物完全溶解,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为硝酸亚铁.由铁元素守恒可知,足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量与硝酸亚铁中的铁的物质的量相同,根据硝酸的物质的量和生成NO的物质的量,求出溶液中硝酸亚铁的物质的量.
解答:
解:n(NO)=
=01mol,
因一定量的Fe、FeO和Fe2O3的混合物中加入120ml 4mol∕L的稀硝酸,恰好使混合物完全溶解,无血红色出现,说明溶液中的溶质为硝酸亚铁,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.12L×4mol/L-0.1mol=0.38mol,所以硝酸亚铁的物质的量为
=0.19mol,由铁元素守恒可知,得到铁的物质的量为n(Fe)=0.19mol.
故选C.
| 2.24L |
| 22.4L/mol |
因一定量的Fe、FeO和Fe2O3的混合物中加入120ml 4mol∕L的稀硝酸,恰好使混合物完全溶解,无血红色出现,说明溶液中的溶质为硝酸亚铁,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.12L×4mol/L-0.1mol=0.38mol,所以硝酸亚铁的物质的量为
| 0.38mol |
| 2 |
故选C.
点评:本题考查学生利用原子守恒的方法来计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确硝酸亚铁与硝酸的关系,硝酸亚铁中铁元素与原混合物中的铁元素的关系是解答的关键.

练习册系列答案
相关题目
实验室常用KClO3晶体和浓盐酸反应制取氯气,反应的化学方程式为KClO3++6HCl(浓)═KCl+3Cl2↑+3H2O.
(1)氧化产物是 ,还原产物是 ;
(2)被氧化与被还原的氯原子的数目比是 .
(1)氧化产物是
(2)被氧化与被还原的氯原子的数目比是
下列说法不正确的是( )
A、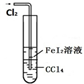 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
B、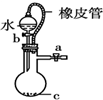 橡皮管的作用是使水能顺利流下 |
C、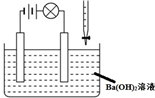 若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮 |
D、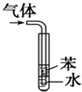 用于吸收HCl气体能防倒吸 |
下列物质的检验,其结论一定正确的是( )
| A、向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- |
| B、向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- |
| C、取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
| D、能使湿润的碘化钾淀粉试纸变蓝的一定是Cl2 |
下列实验操作中和事故、药品的处理中正确的是( )
| A、“粗盐提纯“的实验中,当蒸发皿中出现较多固体时,停止加热 |
| B、少量浓硫酸沾在皮肤上立即用氢氧化钠冲洗 |
| C、有腐蚀性D的药品直接放在天平托盘上称重 |
| D、提取溴水中的溴时,可以选择酒精灯、作萃取剂 |
下列关于反应热及能量变化的说法正确的是( )
| A、当△H<0时,表示该反应为吸热反应 |
| B、放热反应可以自发进行,而吸热反应需加热才能进行 |
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D、化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |