题目内容
18.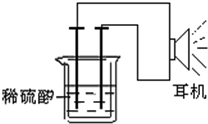 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:(1)实验原理:Fe+2H+=Fe2++H2↑.
(2)实验用品:电极(铁钉或铁条、铜钉(其他的惰性电极如铅笔 芯、铂等都可以) )、稀硫酸烧杯、导线、(填写所缺的实验用品)、耳机(或者电流计)
(3)实验装置
(4)原电池设计及注意的问题
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓…”声音.其原因是:在原电池中,由化学能转化为电能,在耳机中又由 其转化为声音这种能量.
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的负 极,电极反应是:Fe-2e-=Fe2+;,发生了氧化 反应.
分析 由反应Fe+2H+=Fe2++H2↑可知,反应中Fe被氧化,应为原电池的负极,则正极可为活泼性较铁弱的金属或非金属单质,注意形成原电池的条件以及能量的转化形成,以此解答.
解答 解:(2)由形成原电池的条件可知,需要铁为负极,正极为铜钉(其他的惰性电极如铅笔 芯、铂等都可以),硫酸为电解质溶液,还需要烧杯、导线等,
故答案为:铁钉或铁条;铜钉(其他的惰性电极如铅笔 芯、铂等都可以);烧杯、导线;
(4)①在原电池中,由化学能转化为电能,在耳机中又由电能转化为声音这种能量;故答案为:电能;
②如果将装置中的耳机改为电流计,则电流表指针发生偏转,形成原电池反应,铁为负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,发生氧化反应,
故答案为:负;Fe-2e-=Fe2+;氧化.
点评 本题考查原电池及工作原理,为高频考点,侧重于学生的分析能力和实验能力的考查,把握原电池反应与氧化还原反应的关系为解答的关键,难度不大.

练习册系列答案
相关题目
13.原电池产生电流的本质原因是( )
| A. | 原电池中溶液能电离出自由移动的离子 | |
| B. | 电极上进行的氧化还原反应的生成物为电子 | |
| C. | 有两根导线将两个活泼性不同的电极连接 | |
| D. | 电极上进行的氧化还原反应中发生了电子的转移 |
3.下列叙述正确的是( )
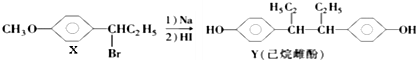
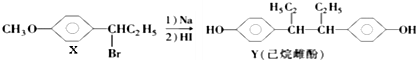
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与Br2发生加成反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
7.表为几种短周期元素的性质,有关说法正确的是( )
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-1nm) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤ | |
| B. | ③④处于同一周期 | |
| C. | 元素⑤的氢化物沸点高于元素①的氢化物 | |
| D. | ⑧号元素位于周期表中第三周期第ⅢA族 |
8.下列反应属于吸热反应的是( )
| A. | 铝片与硫酸的反应 | |
| B. | 氢气在氧气中燃烧 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
 .
.