题目内容
13.原电池产生电流的本质原因是( )| A. | 原电池中溶液能电离出自由移动的离子 | |
| B. | 电极上进行的氧化还原反应的生成物为电子 | |
| C. | 有两根导线将两个活泼性不同的电极连接 | |
| D. | 电极上进行的氧化还原反应中发生了电子的转移 |
分析 原电池反应的本质为氧化还原反应,在反应中有电子的转移,在闭合电路中可形成电流,以此解答该题.
解答 解:原电池中,外电路中,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极;
内电路中,电解质溶液中的阴离子向负极移动,阳离子向正极移动,所以形成了闭合回路,产生了电流,
所以电极上进行的氧化还原反应中发生了电子的转移是原电池产生电流的本质原因.
故选D.
点评 本题考查了原电池产生电流的本质原因,侧重于基本理论知识的综合理解和运用的考查,难度不大,注意只有在闭合回路中才可能产生电流.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
3.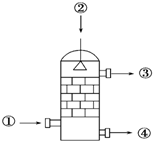 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )| A. | 从①处通入SO3,整个吸收操作采取逆流的形式 | |
| B. | 从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积 | |
| C. | 从③处导出的气体只含有少量SO2,可直接排入大气 | |
| D. | 从④处流出的是可用水或稀硫酸稀释的浓硫酸 |
4.下列各组物质不属于同分异构体的是( )
| A. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| B. | 对氯甲苯和邻氯甲苯 | |
| C. | 2-甲基丁烷和戊烷 | |
| D. | 甲基丙烯酸和甲酸丙酯 |
1.表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素是Ar.(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是Na>Mg>F (用元素符号表示)
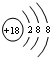
(3)用电子式表示③与⑦形成化合物的过程 .
.
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH.(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2(填化学式),可用什么化学反应说明(写出反应的化学方程式):Cl2+2Br-=2Cl-+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)②③④三种元素的原子半径从大到小的顺序是Na>Mg>F (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程
 .
.(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH.(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2(填化学式),可用什么化学反应说明(写出反应的化学方程式):Cl2+2Br-=2Cl-+Br2.
5.下列有关元素的性质及其递变规律正确的是( )
| A. | IA族与ⅦA族元素间形成的化合物都是离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子从上到下还原性减弱 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
3.短周期主族元素A、B、C、D、E的原子序数依次递增,A的单质在常温下呈气态,D元素的单质既能与盐酸反应也能与NaOH溶液反应,B、C、E原子的最外层电子数之和为13,E原子的最外层电子数是B原子内层电子数的3倍或是C原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(B)>r(C)>r(A) | |
| B. | 元素E的氧化物的水化物一定是强酸 | |
| C. | D单质在一定条件下可以与氧化铁发生置换反应 | |
| D. | C、D的氯化物都是离子化合物 |
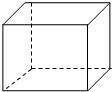 “立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示: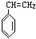 .
.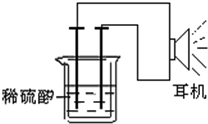 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白: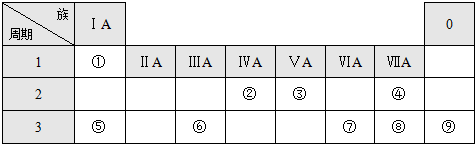
 .
.