题目内容
 某溶液中可能含有的离子如下表:
某溶液中可能含有的离子如下表:| 可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、CO32-、[Al(OH)4]-、I- |
A.该溶液中确定含有的离子有H+、Al3+、NH4+
B.肯定不存在的阴离子有CO32+、[Al(OH)4]-、I-
C.不能确定是否含有的阳离子有K+
D.溶液中含有的Al3+和NH4+的物质的量之比为1:2.
考点:离子方程式的有关计算,离子反应发生的条件
专题:计算题
分析:根据产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,刚加入氢氧化钠溶液时,没有产生沉淀;溶液中一定含有H+,能够与氢离子反应离子不能存在;一定没有CO32-、[Al(OH)4]-;之后产生了沉淀,且沉淀完全溶解;则溶液中只含有Al3+,沉淀溶解前产生了气体,该气体一定是氨气;则推断溶液中一定含有NH4+,K+不能确定,若要确定K+,可通过焰色反应确定,根据以上分析依据,分别对离子存在情况作出判断.
解答:
解:根据图示,开始时没有沉淀生成,说明溶液中氢离子,能够与氢离子反应离子不能存在;一定没有CO32-、[Al(OH)4]-;加NaOH有气体放出,则推断溶液中一定含有NH4+,沉淀最后完全消失,则溶液中只含有Al3+,K+不能确定,若要确定K+,可通过焰色反应确定,所以溶液中确定含有的阳离子有:H+、NH4+、Al3+;不能确定的离子为:K+;肯定不存在的阴离子有:CO32-、[Al(OH)4]-,不能确定的有Cl-、Br-、I-.
A.该溶液中确定含有的离子有H+、NH4+、Al3+,故A正确;
B.一定不存在CO32-、[Al(OH)4]-,不能确定I-,故B错误;
C.不能确定的有Cl-、Br-、I-、和K+,若要确定K+,可通过焰色反应确定,故C正确;
D.根据图示,溶解氢氧化铝消耗了氢氧化钠溶液体积是生成氨气消耗氢氧化钠溶液体积的一半,故溶液中含有的Al3+和NH4+的物质的量之比为1:2,故D正确;
故选B.
A.该溶液中确定含有的离子有H+、NH4+、Al3+,故A正确;
B.一定不存在CO32-、[Al(OH)4]-,不能确定I-,故B错误;
C.不能确定的有Cl-、Br-、I-、和K+,若要确定K+,可通过焰色反应确定,故C正确;
D.根据图示,溶解氢氧化铝消耗了氢氧化钠溶液体积是生成氨气消耗氢氧化钠溶液体积的一半,故溶液中含有的Al3+和NH4+的物质的量之比为1:2,故D正确;
故选B.
点评:本题是离子推断题,考查离子的检验方法及图示理解、分析能力,题目难度中等,充分考查了学生的分析、理解能力,要求熟练掌握常见离子的检验方法,能够根据反应现象推断存在离子.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
下列化学用语正确的是( )
| A、H2O的结构式:H-O-H |
| B、乙醇的结构简式:C2H6O |
C、H2O2的电子式: |
D、14C的原子结构示意图: |
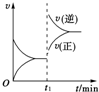 如图为某可逆反应的速率与时间的关系示意图,在t1时刻改变的条件为升温或增大压强,则该可逆反应可以是(提示:即升温或增大压强时均能符合如右图所示的速率与时间图象)( )
如图为某可逆反应的速率与时间的关系示意图,在t1时刻改变的条件为升温或增大压强,则该可逆反应可以是(提示:即升温或增大压强时均能符合如右图所示的速率与时间图象)( )| A、4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 |
| B、2SO2(g)+O2(g)═2SO3(g)△H<0 |
| C、H2(g)+I2(g)═2HI(g)△H>0 |
| D、C(s)+H2O(g)═CO(g)+H2(g)△H>0 |
某固体粉末X中可能含有FeO、Fe2O3、MnO2、K2S、K2SO3、KAlO2、MgCl2、K2SO4、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下: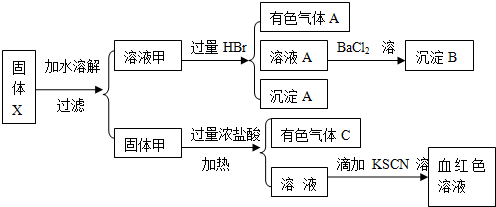 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )
 根据上述实验,以下说法正确的是( )
根据上述实验,以下说法正确的是( )| A、原混合物中一定不含有MgCl2 |
| B、气体A的成分可能超过2种 |
| C、溶液甲中一定含有Na2SiO3、NaNO2、K2SO4可能含有K2CO3、K2SO3 |
| D、固体甲中除MnO2外,可能只含有FeO |
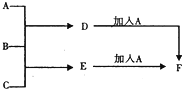 A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴人沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如图,下列推断正确的是( )
A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴人沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如图,下列推断正确的是( )| A、物质B是H2 |
| B、物质C是Cl2 |
| C、物质D是FeCl2 |
| D、物质F是FeCl2 |
 滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.