题目内容
3.海洋是一个巨大的化学资源宝库.海水综合利用的部分流程如下:
已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.
(1)电解饱和NaCl溶液的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,粗盐中常含Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH溶液、BaCl2、Na2CO3、稀盐酸来进行提纯.
(2)下列方法可用于海水淡化的是A.(填字母)
A.蒸馏法 B.萃取法 C.过滤法
(3)工业上用电解法制Mg时,通常在MgCl3中加入CaCl2,其原因是:①增加电解质的密度,便于分离出熔融的镁:②使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗.
(4)用母液(含Na+、K+、Mg2+、C1-、Br-等离子)提取溴,其生产流程如下:

①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑.
②母液中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液富集溴,提高Br2的浓度.
③向蒸馏塔中通人水蒸气加热,控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
分析 海水淡化得到淡水,另外蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐;母液加氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氯化镁,制得氯化镁,母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴.
(1)惰性电极电解NaCl溶液,生成NaOH、氢气、氯气;粗盐中含有Ca2+、Mg2+及SO42-,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子;
(2)海水淡化海水就是将海水中的可溶性杂质除去的过程,可根据淡化原理进行分析;
(3)用电解法制Mg时,通常在MgCl2中加入CaCl2,可使氯化镁熔融温度降低,从而减少能耗;
(4)由流程可知,①中发生2Br-+Cl2=2Cl-+Br2,利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,在吸收塔中的溶液含BrO3-,可知发生3CO32-+3Br2=5Br-+BrO3-+3CO2↑,③中发生5Br-+BrO3-+6H+=3Br2+3H2O,最后利用蒸馏得到溴,以此来解答.
解答 解:(1)惰性电极电解NaCl溶液,阳极上是氯离子失电子,2Cl--2e-=Cl2↑,阴极上是氢离子得电子,2H++2e-=H2↑,由两极上的电极反应可以得到总反应为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂可依次加入NaOH、BaCl2、Na2CO3、HCl,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;BaCl2;Na2CO3;
(2)A.蒸馏法,是把水从水的混合物中分离出来,得到纯净的水,故A正确;
B.萃取法,对于微溶于水的有机物,可用萃取法,水中没有微溶于水的有机物,故B错误;
C.过滤是分离固体和溶液的操作,不能淡化水,故C错误
故答案为:A;
(3)离子浓度越大其熔融盐的导电性越强,在MgCl2中加入CaCl2,进行电解,增大离子浓度,从而增大熔融盐的导电性,使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗,
故答案为:使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗;
(4)由流程可知,①中发生2Br-+Cl2=2Cl-+Br2,利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,在吸收塔中的溶液含BrO3-,可知发生3CO32-+3Br2=5Br-+BrO3-+3CO2↑,③中发生5Br-+BrO3-+6H+=3Br2+3H2O,最后利用蒸馏得到溴,
①纯碱是碳酸钠,与溴反应有BrO3-生成,反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,
故答案为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑;
②从①出来的溶液中溴的含量不高,如果直接蒸馏,得到产品成本高,所以经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的为富集溴,提高Br2的浓度,
故答案为:富集溴,提高Br2的浓度;
③温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏,
故答案为:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
点评 本题考查海水资源综合利用,涉及了离子的除杂、氧化还原反应、元素及其化合物的有关知识进行综合利用、混合物分离提纯及溴的制备,提高了试题的综合性,为高频考点,把握流程中的反应及物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度中等.

 应用题作业本系列答案
应用题作业本系列答案| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的脱氧剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 过滤用到的玻璃仪器有铁架台、烧杯、漏斗、玻璃棒、滤纸 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
| A. | Na+、Cu2+、Cl-、CO32- | B. | HCO3-、Cl-、Fe3+、Na+ | ||
| C. | Cl-、K+、NO3-、Fe2+、 | D. | S2-、SO42-、NH4+、Fe2+ |
| A. | 0.1mol•L -1AgNO3,溶液:H+、K+、SO42-、I- | |
| B. | c( H+ )/c( OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的 c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | 甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl- |
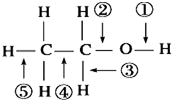
| A. | 乙醇与钠反应,键①断裂 | |
| B. | 乙醇在Ag催化作用下与O2反应,键①③断裂 | |
| C. | 乙醇完全燃烧时,只有①②键断裂 | |
| D. | 乙醇与氢卤酸反应,键②断裂 |
| A. | 1mol/LBaCl2溶液中含有的Ba2+数为NA | |
| B. | 1mol镁离子中含有的电子数为2NA | |
| C. | 常温常压下,11.2LH2中含有H2数为0.5NA | |
| D. | 16gO3中含有氧原子数为NA |
| A. | 1molNa被完全氧化生成Na2O2时失去2mole- | |
| B. | Na2O2常用作呼吸面具的供氧剂,使用过程中涉及氧化还原反应 | |
| C. | 热稳定性:NaHCO3>Na2CO3 | |
| D. | 纯碱是面包发酵粉和碱性洗涤剂的主要成分之一 |
| 欲提纯物质与杂质 | 所选试剂 |
| Fe (Al) | |
| Al2O3(Al) | |
| FeCl2 (FeCl3) | |
| FeCl3 (FeCl2) | |
| SiO2 (CaCO3) |
(3)在400mL2mol•L-1 Ba(OH)2溶液中,溶质的物质的量是0.8mol.此溶液中OH-的物质的量浓度为4mol•L-1,Ba2+的物质的量浓度为2mol•L-1.
 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.