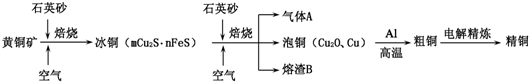
题目内容
现有A、B、C、D、E、F六种物质,它们均由互不相同的两种离子组成,已知它们的阳离子有:H+、K+、NH4+、Ca2+、Ba2+、Al3+,阴离子有:OH-、Cl-、ClO-、NO3-、CO32-、SO42-.将上述六种物质溶于水均配成0.1mol/L溶液,进行如下实验.
①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C.
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失.
③向F中加入A有无色气体生成.
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体.
(1)根据以上信息,填写下列溶液中溶质的化学式.
A C E
(2)书写D与过量的E反应的离子方程式 .
(3)书写实验④中反应的离子方程式 .
(4)向100mLA溶液中慢慢滴加入75mLF溶液和向75mLF溶液中慢慢滴加入100mLA溶液产生的气体体积之比约为 .
①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C.
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失.
③向F中加入A有无色气体生成.
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体.
(1)根据以上信息,填写下列溶液中溶质的化学式.
A
(2)书写D与过量的E反应的离子方程式
(3)书写实验④中反应的离子方程式
(4)向100mLA溶液中慢慢滴加入75mLF溶液和向75mLF溶液中慢慢滴加入100mLA溶液产生的气体体积之比约为
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:①测得溶液A、C、D呈酸性,三种溶液为酸液或水解呈酸性的溶液,且酸性为A>D>C,则A为酸,溶液中含有大量的H+离子,H+离子与OH-、ClO-、CO32-、等离子不能大量共存,故A只能为盐酸;
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,可知D中有铝离子,而E中应有氢氧根,且含钡离子,E为氢氧化钡;
③F中加入A有无色气体生成,所以可推敲气体为二氧化碳,F中有碳酸根,和碳酸根离子不共存的离子不能存在;
④次氯酸根与氯离子还有氢离子结合生成水与氯气,以此来解答.
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,可知D中有铝离子,而E中应有氢氧根,且含钡离子,E为氢氧化钡;
③F中加入A有无色气体生成,所以可推敲气体为二氧化碳,F中有碳酸根,和碳酸根离子不共存的离子不能存在;
④次氯酸根与氯离子还有氢离子结合生成水与氯气,以此来解答.
解答:
解:①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C,所以可推测A中有氢离子,且无碳酸根、次氯酸根、氢氧根;
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,看到沉淀量减少但不消失,很明了的就可知D有铝离子,而且D显酸性,所以D含硫酸根离子,D为硫酸铝,而E中应有氢氧根,且含钡离子,E为氢氧化钡;
③向F中加入A有无色气体生成,所以可推敲气体为二氧化碳,F中有碳酸根,且不含H+、Ca2+、Ba2+、Al3+;
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体,有色且有刺激性气体比较常见的第一反应就是氯气,且正好这又有次氯酸根和氯离子,可想到是次氯酸根与氯离子还有氢离子结合生成水与氯气,所以可知A是盐酸,而B中有次氯酸根,因为C呈酸性,所以它的阳离子为弱碱的阳离子,所以C中有铵根离子和硝酸根离子,所以C为硝酸铵,因为B和F都可溶,所以F为碳酸钾,B为次氯酸钙.
(1)根据上述可知,A为HCl,C为NH4NO3,E为Ba(OH)2,故答案为:HCl;NH4NO3;Ba(OH)2;
(2)硫酸铝和过量的氢氧化钡反应的离子方程式为:2Al3++3SO42-+8OH-+3Ba2+=2AlO2-+3BaSO4↓+4H2O,
故答案为:2Al3++3SO42-+8OH-+3Ba2+=2AlO2-+3BaSO4↓+4H2O;
(3)次氯酸钙和浓盐酸混合后发生反应会生成氯气,即Cl-+ClO-+2H+=Cl2↑+H2O,
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
(4)向100mLHCl溶液中慢慢滴加入75mL碳酸钾溶液,发生反应HCl+K2CO3=KHCO3+KCl,KHCO3+HCl=KCl+H2O+CO2↑,
则HCl+K2CO3=KHCO3+KCl
75 75 75 75
KHCO3+HCl=KCl+H2O+CO2↑,
25 25 25
向75mL碳酸钠溶液中慢慢滴加入100mL盐酸溶液,发生反应为K2CO3+2HCl=2KCl+H2O+CO2↑,
则K2CO3+2HCl=2KCl+H2O+CO2↑,
50 100 50
从上面两种反应情况可以看出:产生的气体体积之比为1:2,
故答案为:1:2.
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,看到沉淀量减少但不消失,很明了的就可知D有铝离子,而且D显酸性,所以D含硫酸根离子,D为硫酸铝,而E中应有氢氧根,且含钡离子,E为氢氧化钡;
③向F中加入A有无色气体生成,所以可推敲气体为二氧化碳,F中有碳酸根,且不含H+、Ca2+、Ba2+、Al3+;
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体,有色且有刺激性气体比较常见的第一反应就是氯气,且正好这又有次氯酸根和氯离子,可想到是次氯酸根与氯离子还有氢离子结合生成水与氯气,所以可知A是盐酸,而B中有次氯酸根,因为C呈酸性,所以它的阳离子为弱碱的阳离子,所以C中有铵根离子和硝酸根离子,所以C为硝酸铵,因为B和F都可溶,所以F为碳酸钾,B为次氯酸钙.
(1)根据上述可知,A为HCl,C为NH4NO3,E为Ba(OH)2,故答案为:HCl;NH4NO3;Ba(OH)2;
(2)硫酸铝和过量的氢氧化钡反应的离子方程式为:2Al3++3SO42-+8OH-+3Ba2+=2AlO2-+3BaSO4↓+4H2O,
故答案为:2Al3++3SO42-+8OH-+3Ba2+=2AlO2-+3BaSO4↓+4H2O;
(3)次氯酸钙和浓盐酸混合后发生反应会生成氯气,即Cl-+ClO-+2H+=Cl2↑+H2O,
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
(4)向100mLHCl溶液中慢慢滴加入75mL碳酸钾溶液,发生反应HCl+K2CO3=KHCO3+KCl,KHCO3+HCl=KCl+H2O+CO2↑,
则HCl+K2CO3=KHCO3+KCl
75 75 75 75
KHCO3+HCl=KCl+H2O+CO2↑,
25 25 25
向75mL碳酸钠溶液中慢慢滴加入100mL盐酸溶液,发生反应为K2CO3+2HCl=2KCl+H2O+CO2↑,
则K2CO3+2HCl=2KCl+H2O+CO2↑,
50 100 50
从上面两种反应情况可以看出:产生的气体体积之比为1:2,
故答案为:1:2.
点评:本题考查物质的鉴别和检验,为高频考点,把握物质之间的反应、物质的性质为解答的关键,侧重分析、计算及推断能力的考查,注意离子共存及电荷守恒的应用,题目难度不大.

练习册系列答案
相关题目
核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
下列说法正确的是( )
| A、所有的放热反应都能在常温常压下自发进行 |
| B、Ba(OH)2?8H2O与NH4Cl反应属于放热反应 |
| C、天然气燃烧时,其化学能全部转化为热能 |
| D、反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
(1)P和S (2)Mg和Ca (3)Al和Si三组原子中,分别找出第一电离能较高的原子,这三种原子的原子序数之和是( )
| A、40 | B、48 | C、41 | D、49 |
 在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题: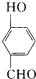 比
比 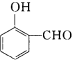 的沸点
的沸点