题目内容
8.按要求书写热化学方程式:(1)由氢气和氧气反应生成1mol水蒸气,放热241.8kJ.写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol.若9g水蒸气转化成液态水放热22kJ,则反应H2(g)+$\frac{1}{2}$O2(g)═H2O(l)的△H=-285.5 kJ•mol-1.
(2)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(3)25oC、101kPa条件下充分燃烧一定量的丁烷(C4H10)气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出表示丁烷燃烧热的热化学方程式C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-16QkJ/mol.
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③H2(g)+1/2O2(g)═H2O(l)△H3=-285.8kJ•mol-1
写出由C(s)、H2(g)和O2(g)经合生成CH3COOH(l)的热化学方程式2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol.
(5)已知拆开1mol H-H键、1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成1mol NH3(g)的热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
分析 (1)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;根据m=nM计算1mol水的质量为18g,进而计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热;
(2)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(3)根据生成碳酸钙的质量计算丁烷的物质的量,结合燃烧热的概念书写表示丁烷燃烧热化学方程式;
(4)利用盖斯定律计算反应热,并书写热化学方程式;
(5)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;9g水蒸气转化成液态水放热22kJ,故18g水蒸气转化成液态水放出热量22kJ×2=44kJ,即H2O(g)=H2O(l)△H=-44kJ/mol①,H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol②,①+②得,H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-(241.8kJ/mol+44kJ/mol)=-285.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;-285.5;
(2)1mol H2SO4溶液与足量 NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-114.6kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(3)n(CaCO3)=$\frac{25g}{100g/mol}$=0.25mol,
Ca(OH)2+CO2=CaCO3+H2O
1 1
0.25mol 0.25mol
即丁烷燃烧生成的二氧化碳为0.25mol.
2C4H10+13O2=8CO2+10H2O
2 8
x 0.25mol
x=$\frac{1}{16}$mol
因为燃烧$\frac{1}{16}$mol的丁烷放出的热量为Q,则丁烷的燃烧热为16Q,
所以表示丁烷燃烧热化学方程式为 C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-16QkJ/mol,
故答案为:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-16QkJ/mol;
(4)已知:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l )△H3=-285.8kJ/mol
利用盖斯定律将②×2+③×2-①可得:
2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
所以热化学方程式为2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol,
故答案为:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol;
(5)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,故热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题考查热化学方程式的书写及利用盖斯定律的计算,题目难度中等,注意把握中和热和燃烧热的概念.

| A. | 30 g由14C2H2和C18O组成的混合气体中含有的质子数为14NA | |
| B. | 1 mol H2与1 mol I2 (g)混合后充分反应生成的HI分子数为2NA | |
| C. | 1 mol乙醇经催化氧化生成乙醛后转移的电子数为4NA | |
| D. | 25℃时,100 mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA |
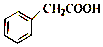 环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )
环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )| A. | 与苯甲酸互为同系物 | |
| B. | 有6种含酯基的芳香化合物与其互为同分异构体 | |
| C. | 能发生取代反应和加成反应 | |
| D. | 与CH3CH2OH所生成酯的分子式为C10H14O2 |
| A. | 向稀NaOH溶液中通入Cl2:Cl2+2OH-═ClO-+Cl-+H2O | |
| B. | 向Fe2(SO4)3溶液中加入铜粉:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 向氨水中通入过量SO2:SO2+OH-═HSO3- |
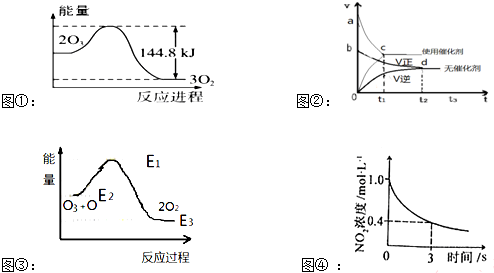
| A. | 据图①可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. | 据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo | |
| C. | 据图③可判断:2O2(g)═O3(g)+O(g)△H>0 | |
| D. | 据图④可判断:2NO2(g)+O3(g)?N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol•L-1•S-1 |
| 编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.010mol•L-1•min-1.
| A. | 卤水点豆腐、明矾净水的原理都是破坏胶体的介稳性 | |
| B. | 铁、铝、铜制容器放置空气中都能在表面形成致密氧化物 | |
| C. | 单晶Ge是半导体,可以作为光电转换材料用于太阳能电池 | |
| D. | 检测酒后驾车者呼出气中的乙醇属于化学检测方法 |
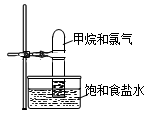 将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.
将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.