题目内容
16.已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同.F是第四周期d区原子序数最大的元素.请回答下列问题:(1)写出E的价层电子排布式.
(2)A、B、C、D电负性由大到小的顺序为O>N>C>H(填元素符号).
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃,沸点43℃.不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为分子晶体,F与BD之间的作用力为配位键.
(4)开发新型储氢材料是氢能利用的重要研究方向.
①由A、B、E三种元素构成的某种新型储氢材料的理论结构模型如图1所示,图中虚线框内B原子的杂化轨道类型有3种;

②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号);
A.H20 B.CH4 C.HF D.CO(NH2)2
③F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如图2所示,晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为LaNi5;已知其摩尔质量为Mg.mol-1,晶胞参数为apm,用NA表示阿伏伽德罗常数,则该晶胞的密度为$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$g.cm-3.
分析 A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.
A的质子数、电子层数、最外层电子数均相等,则A为H元素;
B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;
D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;
E4+与氩原子的核外电子排布相同,则E为Ti元素;
F是第四周期d区原子序数最大的元素,则F为Ni元素,据此解答.
解答 解:A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.
A的质子数、电子层数、最外层电子数均相等,则A为H元素;
B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;
D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;
E4+与氩原子的核外电子排布相同,则E为Ti元素;
F是第四周期d区原子序数最大的元素,则F为Ni元素,
(1)E为22号元素Ti,其价层电子排布式为3d24s2,
故答案为:3d24s2;
(2)同周期元素从左到右电负性逐渐增大,电负性由大到小的顺序为O>N>C>H,
故答案为:O>N>C>H;
(3)Ni(CO)4熔沸点较低,为分子晶体;Ni为过渡元素容易提供空轨道,而CO提供孤对电子,二者形成配位键,
故答案为:分子晶体;配位键;
(4)①图中虚线框内碳原子之间的化学键有C-C、C=C、C≡C,其杂化类型分别为sp3杂化、sp2杂化、sp杂化,所以杂化轨道类型有3种,
故答案为:3种;
②CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,
故答案为:BC;
③该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1+8×$\frac{1}{2}$=5,晶胞实际含有的镧原子为8×$\frac{1}{8}$=1,所以晶体的化学式LaNi5,
晶胞的密度ρ=$\frac{m}{V}$=$\frac{M}{{N}_{A}(a×1{0}^{-10}cm)^{3}}$=$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$,
故答案为:LaNi5;$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$.
点评 题目综合性较大,涉及电负性、晶体、化学键、杂化轨道、晶胞计算等,难度中等,注意运用杂化理论推导分子构型.

 优加精卷系列答案
优加精卷系列答案| A. | NH4Cl | B. | HCOOH | C. | NH3•H2O | D. | Al(OH)3 |
反应试剂、产物的物理常数:
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
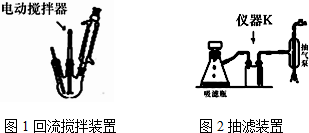
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
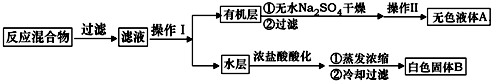
(1)仪器K的名称为安全瓶.无色液体A的结构简式为
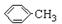 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
| A. | 金属钠与水反应:Na+H2O═Na++H2 | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O═NH3•H2O+H+ | |
| C. | AICl3溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+4NH4+2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S═2Fe2++S+2H+ |
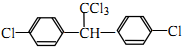 .下列有关DDT的说法正确的是( )
.下列有关DDT的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共平面 | ||
| C. | 分子式为C14H9Cl5 | D. | 能发生水解反应和消去反应 |
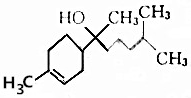
| A. | 分子式为C15H26O | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能与乙酸发生取代反应 |
| A. | 电解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| B. | 标准状况下,35.5 g 氯气与足量红热的铁充分反应得到的电子数一定为NA | |
| C. | 标准状况下,2.24 L HF中含有的原子数为0.2NA | |
| D. | 在密闭容器中加入0.5 moL N2和1.5 moL H2,充分反应后容器中的N-H键数为3NA |
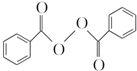 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: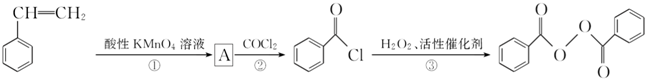
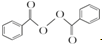 +2H2O→2
+2H2O→2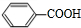 +H2O2;
+H2O2;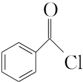 )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;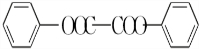 (或
(或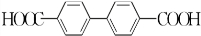 或
或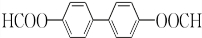 .;
.;