题目内容
11.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 25℃,等物质的量浓度的CH3COO-、ClO-、CO32-和SO32-,结合质子能力最强的是ClO- | |
| B. | 少量的SO2通入Na2CO3溶液中反应的离子方程式为:SO2+H2O+2CO32-═2HCO3-+SO32- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═CO32-+2HClO |
分析 弱酸的电离平衡常数越大,其酸性越强,酸的电离平衡常数H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,则酸性:H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答 解:酸的电离平衡常数H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,则酸性:H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,
A.酸性:CH3COOH>H2CO3>HSO3->HClO>HCO3-,则酸性越强,对应离子结合质子能力越弱,则结合质子能力最强的为CO32-,故A错误;
B.酸性:H2SO3>H2CO3>HSO3-,所以少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3-,故B正确;
C.二氧化硫具有还原性,次氯酸根离子具有氧化性,二者能发生氧化还原反应生成硫酸根离子和氯离子,所以少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,故C错误;
D.H2CO3>HClO>HCO3-,所以少量的CO2通入NaClO溶液中碳酸氢根离子和次氯酸,正确的离子方程式为:CO2+H2O+ClO-═HCO3-+HClO,故D错误;
故选B.
点评 本题考查弱电解质的电离、盐类的水解、氧化还原反应等知识点,注意二氧化硫能被次氯酸根离子氧化生成硫酸根离子,注意盐类水解程度大小的比较方法,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
11.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+H2O═Na++H2 | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O═NH3•H2O+H+ | |
| C. | AICl3溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+4NH4+2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S═2Fe2++S+2H+ |
8.红没药醇是春黄菊花中的活性成分,具有消炎的作用,其结构如图所示.下列有关红没药醇的说法错误的是( )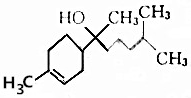

| A. | 分子式为C15H26O | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能与乙酸发生取代反应 |
6.一个恒容容器中盛有1molNO2,发生反应:2NO2(g)?N2O4(g),反应达到平衡时,混合气体中NO2所占体积分数为M%.保持温度不变,再投入1molNO2,达到平衡时,混合气体中NO2所占体积分数为N%.则M和N的关系是( )
| A. | M>N | B. | M<N | C. | M=N | D. | 不能确定 |
16.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 电解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| B. | 标准状况下,35.5 g 氯气与足量红热的铁充分反应得到的电子数一定为NA | |
| C. | 标准状况下,2.24 L HF中含有的原子数为0.2NA | |
| D. | 在密闭容器中加入0.5 moL N2和1.5 moL H2,充分反应后容器中的N-H键数为3NA |
3.某种催化剂为铁的氧化物.化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现红色.一位同学由此得出该催化剂中铁元素价态为+3的结论.
(1)请指出该结论是否合理并说明理由不合理,Fe2+会被硝酸氧化为Fe3+,无法得知原催化剂中一定是否存在Fe3+.
(2)请完成对铁元素价态的探究:限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3mol•L-1H2SO4、3% H2O2、6mol•L-1HNO3、0.01mol•L-1KMnO4、NaOH稀溶液、0.1mol•L-1Kl、
20% KSCN、蒸馏水.
①提出合理假设
假设1:该催化剂中铁元素价态为+3;
假设2:该催化剂中铁元素价态为+2;
假设3:该催化剂中铁元素价态既有+2,也有+3.
②以下是某同学设计的实验验证方案,请将实验操作步骤、预期现象与结论补充完整.
(1)请指出该结论是否合理并说明理由不合理,Fe2+会被硝酸氧化为Fe3+,无法得知原催化剂中一定是否存在Fe3+.
(2)请完成对铁元素价态的探究:限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3mol•L-1H2SO4、3% H2O2、6mol•L-1HNO3、0.01mol•L-1KMnO4、NaOH稀溶液、0.1mol•L-1Kl、
20% KSCN、蒸馏水.
①提出合理假设
假设1:该催化剂中铁元素价态为+3;
假设2:该催化剂中铁元素价态为+2;
假设3:该催化剂中铁元素价态既有+2,也有+3.
②以下是某同学设计的实验验证方案,请将实验操作步骤、预期现象与结论补充完整.
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解; | 溶液呈黄绿色,说明溶液中可能含Fe2+和Fe3+. |
| 步骤2:取少量溶液,滴 加0.01mol/L的KMnO4溶液. | 若紫红色不褪去,则说明催化剂中含铁元素的价态+3价;若紫红色褪去, 则说明催化剂中含有铁元素的价态为+2价 |
| 步骤3:另取少量溶液,滴 加20%的KSCN溶液. | 若溶液变为血红色,则说明催化剂中含铁元素的价态+3价;若溶液无变化,则说明催化剂中含铁元素的价态+2价; |
1.在2L 含95gMgCl2 的溶液中,下列说法正确的是( )
| A. | MgCl2 的物质的量浓度为0.5mol•L-1 | |
| B. | Cl-的个数为3.01×1023 | |
| C. | Mg2+的物质的量为2mol | |
| D. | Cl-的物质的量浓度为2mol•L-1 |

