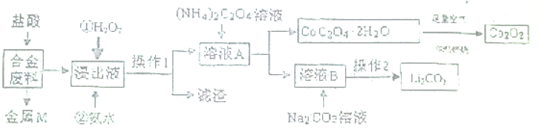
题目内容
为了保护环境,工业上常用氨气除去废气中氮氧化物(NOx):NOx+NH3=N2+H2O(l).已知某厂每升废气中含NOx 0.0672L(只含NO和NO2),向100.000L废气中通入10.000L氨气可使NOx完全转化,测得反应后气体体积变为103.952L(气体体积均折算到标准状况).有关说法中正确的是( )
| A、每生成1.5mol N2被氧化的气体有3mol |
| B、处理过程中转移的电子数目约为1.339Na |
| C、NOx中x的数值为1.2 |
| D、出去废气中的NOx至少需要氨0.24mol |
考点:化学方程式的有关计算
专题:计算题
分析:100L的废气中有NOx物质的量为
=0.3mol,物质的量减少:
=0.27mol;
设混合气体中NO物质的量为x,NO2的物质的量为y,根据化合价升降配平方程式xNO+yNO2+
NH3→
N2 +(x+2y)H2O(l);
根据混合气体中NO和NO2 的物质的量之和为0.3mol、物质的量减少:x+y+
-
=0.27,求出x、y,以此分析选项.
| 100×0.0672L |
| 22.4L/mol |
| (110-103.952)L |
| 22.4mol/L |
设混合气体中NO物质的量为x,NO2的物质的量为y,根据化合价升降配平方程式xNO+yNO2+
| 2x+4y |
| 3 |
x+y+
| ||||
| 2 |
根据混合气体中NO和NO2 的物质的量之和为0.3mol、物质的量减少:x+y+
| 2x+4y |
| 3 |
x+y+
| ||||
| 2 |
解答:
解:100L的废气中有NOx物质的量为
=0.3mol,
物质的量减少:
=0.27mol.
NO+NO2 +NH3 →N2+H2O
↓2↓4↑3
设混合气体中NO物质的量为x,NO2的物质的量为y,
xNO+yNO2+
NH3→
N2 +(x+2y)H2O(l)
物质的量减少:x+y+
-
=0.27 (化简 5x+7y=1.62)
混合气体:x+y=0.3
求出x=0.24,y=0.06,
所以转移的电子数:0.24×2+0.06×4=0.72mol,
将xy数据带入
0.24NO+0.06NO2+0.24NH3=0.27N2+0.48H2O 化简得:
8NO+2NO2+8NH3=9N2+16H2O
A、N2为1.5mol的时候,NH3的物质的量为
mol,故A错误;
B、处理过程中转移的电子数目约为0.72NA,故B错误;
C、根据8NO+2NO2+8NH3=9N2+16H2O,可以知道N为10,O为12,所以为NO1.2,故C正确;
D、根据8NO+2NO2+8NH3=9N2+16H2O可知,除去废气中的NOx至少需要氨气与NO物质的量相等,为0.24molNH3,故D正确;
故选CD.
| 100×0.0672L |
| 22.4L/mol |
物质的量减少:
| (110-103.952)L |
| 22.4mol/L |
NO+NO2 +NH3 →N2+H2O
↓2↓4↑3
设混合气体中NO物质的量为x,NO2的物质的量为y,
xNO+yNO2+
| 2x+4y |
| 3 |
x+y+
| ||||
| 2 |
物质的量减少:x+y+
| 2x+4y |
| 3 |
x+y+
| ||||
| 2 |
混合气体:x+y=0.3
求出x=0.24,y=0.06,
所以转移的电子数:0.24×2+0.06×4=0.72mol,
将xy数据带入
0.24NO+0.06NO2+0.24NH3=0.27N2+0.48H2O 化简得:
8NO+2NO2+8NH3=9N2+16H2O
A、N2为1.5mol的时候,NH3的物质的量为
| 4 |
| 3 |
B、处理过程中转移的电子数目约为0.72NA,故B错误;
C、根据8NO+2NO2+8NH3=9N2+16H2O,可以知道N为10,O为12,所以为NO1.2,故C正确;
D、根据8NO+2NO2+8NH3=9N2+16H2O可知,除去废气中的NOx至少需要氨气与NO物质的量相等,为0.24molNH3,故D正确;
故选CD.
点评:本题以环境保护为信息来考查学生对氧化还原反应的分析,明确元素化合价的变化及电子守恒来配平化学反应是解答本题的关键,难度较大,注重了化学与生活的联系,符合高考的导向.

练习册系列答案
相关题目
13C-NMR(核磁共振)可用于含碳化合物的结构分析,有关13C的说法正确的是( )
| A、质子数为6 |
| B、电子数为13 |
| C、中子数为6 |
| D、质量数为6 |
下列图示关系中不正确的是( )
A、 |
B、 |
C、 |
D、 |
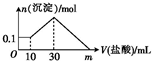 某一固体物质可能由NaOH、AlCl3、FeCl3、SiO2中的几种组成,将一定量的该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol?L-1的盐酸,如图表示盐酸加入量与沉淀量的变化关系,图中m表示已加入的盐酸体积,则m的数值是( )
某一固体物质可能由NaOH、AlCl3、FeCl3、SiO2中的几种组成,将一定量的该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol?L-1的盐酸,如图表示盐酸加入量与沉淀量的变化关系,图中m表示已加入的盐酸体积,则m的数值是( )| A、60 | B、100 |
| C、120 | D、150 |
向下列溶液:①氯水 ②氯酸钾 ③氯化钠 ④四氯化碳中分别加AgNO3溶液和稀HNO3,能生成白色沉淀的是( )
| A、①② | B、②③ | C、①③ | D、②④ |
下列有关化学反应与能量变化的说法中不正确的是( )
| A、物质发生化学反应的同时都伴随着能量变化 |
| B、伴随能量变化的过程都是化学变化 |
| C、在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
| D、并不是所有的化学变化都伴随着能量的放出 |