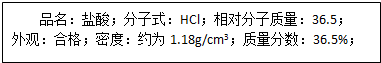
题目内容
(1)某元素形成的微粒的质量数为37,中子数为20,电子数为18,试写出该微粒的结构示意图 .
(2)写出氢氧化钙、硫酸铝的电离方程式 、 .
(3)6.8g某气体在标准状况下体积为8.96L,则该气体的相对原子质量为 ,若该分子的总电子数为10,则该分子的分子式为 .
(4)16gO3与32gO2中氧原子个数比为 .
(2)写出氢氧化钙、硫酸铝的电离方程式
(3)6.8g某气体在标准状况下体积为8.96L,则该气体的相对原子质量为
(4)16gO3与32gO2中氧原子个数比为
考点:原子结构与元素的性质,核素,电离方程式的书写
专题:化学用语专题
分析:(1)该元素形成微粒的质量数为37,中子数为20,则元素原子质子数=37-20=17,微粒电子数为18,核外有3个电子层,各层电子数为2、8、8;
(2)氢氧化钙属于强电解质,完全电离得到钙离子与氢氧根离子;硫酸铝属于强电解质,电离得到铝离子与硫酸根离子;
(3)根据n=
计算气体的物质的量,再根据M=
计算其摩尔质量,进而确定其相对分子质量;结合相对分子质量及分子含有总电子数确定该气体分子式;
(4)O3、O2均由O原子构成,含有的O原子数目之比等于质量之比.
(2)氢氧化钙属于强电解质,完全电离得到钙离子与氢氧根离子;硫酸铝属于强电解质,电离得到铝离子与硫酸根离子;
(3)根据n=
| V |
| Vm |
| m |
| n |
(4)O3、O2均由O原子构成,含有的O原子数目之比等于质量之比.
解答:
解:(1)该元素形成微粒的质量数为37,中子数为20,则元素原子质子数=37-20=17,微粒电子数为18,核外有3个电子层,各层电子数为2、8、8,该微粒结构示意图为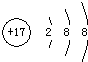 ,故答案为:
,故答案为: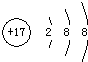 ;
;
(2)氢氧化钙属于强电解质,完全电离得到钙离子与氢氧根离子,电离方程式为:Ca(OH)2=Ca2++2OH-;
硫酸铝属于强电解质,电离得到铝离子与硫酸根离子,电离方程式为:Al2(SO4)3=2Al3++3SO42-,
故答案为:Ca(OH)2=Ca2++2OH-;Al2(SO4)3=2Al3++3SO42-;
(3)标准状况下,8.96L该气体的物质的量=
=0.4mol,该气体的摩尔质量=
=17g/mol,其相对分子质量为17,若该气体分子总电子数为10,则气体为NH3,故答案为:17;NH3;
(4)O3、O2均由O原子构成,含有的O原子数目之比等于质量之比,故16gO3与32gO2中氧原子个数比=16g:32g=1:2,故答案为:1:2.
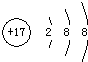 ,故答案为:
,故答案为: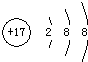 ;
;(2)氢氧化钙属于强电解质,完全电离得到钙离子与氢氧根离子,电离方程式为:Ca(OH)2=Ca2++2OH-;
硫酸铝属于强电解质,电离得到铝离子与硫酸根离子,电离方程式为:Al2(SO4)3=2Al3++3SO42-,
故答案为:Ca(OH)2=Ca2++2OH-;Al2(SO4)3=2Al3++3SO42-;
(3)标准状况下,8.96L该气体的物质的量=
| 8.96L |
| 22.4L/mol |
| 6.8g |
| 0.4mol |
(4)O3、O2均由O原子构成,含有的O原子数目之比等于质量之比,故16gO3与32gO2中氧原子个数比=16g:32g=1:2,故答案为:1:2.
点评:本题考查原子结构、核外电子排布、电离方程式、常用化学计量计算等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
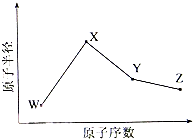 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.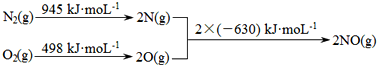
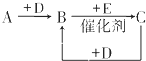 A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).
A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).