题目内容
Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为
(4)组装该电池必须在无水、无氧的条件下进行,原因是 .
(5)用此蓄电池电解含有0.1mol.L-1 CuSO4和0.1mol.L-1 NaCl的混合溶液100mL,假如电路中转移了0.02mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH .
(1)电池的负极材料为
(2)电池正极发生的电极反应为
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为
(4)组装该电池必须在无水、无氧的条件下进行,原因是
(5)用此蓄电池电解含有0.1mol.L-1 CuSO4和0.1mol.L-1 NaCl的混合溶液100mL,假如电路中转移了0.02mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是
考点:化学电源新型电池,电解原理
专题:电化学专题
分析:(1)原电池中,失电子发生氧化反应的极是负极,该极上发生失电子的氧化反应;
(2)原电池的正极上发生得电子的还原反应;
(3)根据SOCl2与NaOH溶液反应的生成物确定SOCl2与水反应的生成物;
(4)根据类比钠的活泼性判断锂的活泼性,根据锂的活泼性以及SOCl2的性质分析;
(5)由离子放电顺序可知,电解含有0.01molCuSO4和0.01molNaCl的混合溶液100ml,阳极上氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,阴极上铜离子得电子,以此计算.
(2)原电池的正极上发生得电子的还原反应;
(3)根据SOCl2与NaOH溶液反应的生成物确定SOCl2与水反应的生成物;
(4)根据类比钠的活泼性判断锂的活泼性,根据锂的活泼性以及SOCl2的性质分析;
(5)由离子放电顺序可知,电解含有0.01molCuSO4和0.01molNaCl的混合溶液100ml,阳极上氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,阴极上铜离子得电子,以此计算.
解答:
解:(1)该原电池中锂的活泼性大于碳的,所以锂作负极,负极上Li失电子,发生氧化反应.
故答案为:锂;Li-e-═Li+;
(2)正极上得电子发生还原反应,根据反应方程式知,SOCl2得电子生成Cl-、S、SO2,电极方程式为2SOCl2+4e-=4Cl-+S+SO2,
故答案为:2SOCl2+4e-=4Cl-+S+SO2;
(3)由NaOH和SOCl2生成Na2SO3和NaCl两种盐知,SOCl2和水生成酸或酸性氧化物,根据原子守恒得,SOCl2和水生成SO2和HCl,即SOCl2+H2O=SO2↑+2HCl↑.
故答案为:SOCl2+H2O=SO2↑+2HCl↑.
(4)锂和钠是同一主族的元素,性质具有相似性,钠和空气中的氧气、水蒸气反应,所以锂和空气中的氧气、水蒸气也能反应;SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行.
故答案为:锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(5)解:计算得到,电解含有0.01mol CuSO4和0.01molNaCl的混合溶液100mL,电路中转移了0.02mol e-,依据电极反应和电子守恒分析判断;
阳极:2Cl--2e-=Cl2↑,
0.01mol 0.01mol 0.005mol
4OH--4e-=2H2O+O2↑,
0.01mol 0.01mol 0.0025mol
阴极:Cu2++2e-=Cu
0.01mol 0.02mol
所以阳极上生成的气体在标准状况下的体积=(0.005mol+0.0025mol)×22.4L/mol=0.168L;
阳极氢氧根离子减少0.01mol,则溶液中氢离子增加0.01mol,将电解后的溶液加水稀释至1L,溶液中氢离子浓度=
=0.01mol/L,溶液PH=2;
故答案为:0.168;2.
故答案为:锂;Li-e-═Li+;
(2)正极上得电子发生还原反应,根据反应方程式知,SOCl2得电子生成Cl-、S、SO2,电极方程式为2SOCl2+4e-=4Cl-+S+SO2,
故答案为:2SOCl2+4e-=4Cl-+S+SO2;
(3)由NaOH和SOCl2生成Na2SO3和NaCl两种盐知,SOCl2和水生成酸或酸性氧化物,根据原子守恒得,SOCl2和水生成SO2和HCl,即SOCl2+H2O=SO2↑+2HCl↑.
故答案为:SOCl2+H2O=SO2↑+2HCl↑.
(4)锂和钠是同一主族的元素,性质具有相似性,钠和空气中的氧气、水蒸气反应,所以锂和空气中的氧气、水蒸气也能反应;SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行.
故答案为:锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(5)解:计算得到,电解含有0.01mol CuSO4和0.01molNaCl的混合溶液100mL,电路中转移了0.02mol e-,依据电极反应和电子守恒分析判断;
阳极:2Cl--2e-=Cl2↑,
0.01mol 0.01mol 0.005mol
4OH--4e-=2H2O+O2↑,
0.01mol 0.01mol 0.0025mol
阴极:Cu2++2e-=Cu
0.01mol 0.02mol
所以阳极上生成的气体在标准状况下的体积=(0.005mol+0.0025mol)×22.4L/mol=0.168L;
阳极氢氧根离子减少0.01mol,则溶液中氢离子增加0.01mol,将电解后的溶液加水稀释至1L,溶液中氢离子浓度=
| 0.01mol |
| 1L |
故答案为:0.168;2.
点评:本题以原电池为载体考查了化学电源新型电池,Li-SOCl2电池虽是新型电池,以教材中Cu-Zn原电池的工作原理为依据,判断该电池的正负极及电极反应式.要学会从教材中找出知识点原型进行知识迁移、解决问题的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
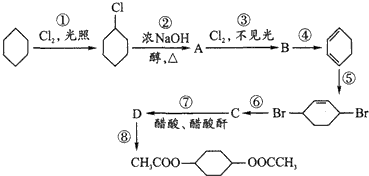
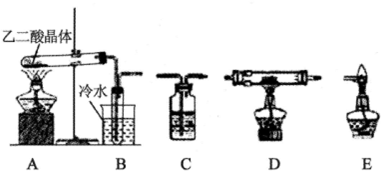
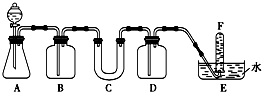 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选择适当的化学试剂和实验用品,用图中的实验装置进行试验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选择适当的化学试剂和实验用品,用图中的实验装置进行试验,证明过氧化钠可作供氧剂.