题目内容
16.高分子材料E和含扑热息痛高分子药物的合成流程如图所示:
已知:Ⅰ.含扑热息痛高分子药物的结构为:
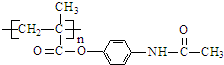 .
.Ⅱ.

Ⅲ.

(1)①的反应类型为加成反应,G的分子式为C4H5OCl.
(2)若1mol
 与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
.(3)反应②为加成反应,则B的结构简式为
 ;扑热息痛的结构简式为
;扑热息痛的结构简式为 .
.(4)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32%.D分子中所含含氧官能团的名称为酯基.
(5)含扑热息痛高分子药物与足量NaOH溶液反应的化学方程式
 .
.
分析 苯和丙烯发生加成反应生成异苯丙烷,异苯丙烷被氧化生成A和B,B和氢氰酸发生加成反应生成 ,则B是丙酮,1mol
,则B是丙酮,1mol  可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是苯酚,
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是苯酚, 发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,D的相对分子质量是100,则D的分子式为:C5H8O2,D的不饱和度=$\frac{2×5+2-8}{2}$,所以D中含有碳碳双键,且含有酯基,所以D的结构简式为:CH2=C(CH3)COOCH3,D发生加聚反应生成F;异丙烯酸和SOCl2发生取代反应生成G,G的结构简式为:CH2=C(CH3)COCl,G反应生成H,H反应生成
发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,D的相对分子质量是100,则D的分子式为:C5H8O2,D的不饱和度=$\frac{2×5+2-8}{2}$,所以D中含有碳碳双键,且含有酯基,所以D的结构简式为:CH2=C(CH3)COOCH3,D发生加聚反应生成F;异丙烯酸和SOCl2发生取代反应生成G,G的结构简式为:CH2=C(CH3)COCl,G反应生成H,H反应生成 ,则H是
,则H是 ,据此答题.
,据此答题.
解答 解:苯和丙烯发生加成反应生成异苯丙烷,异苯丙烷被氧化生成A和B,B和氢氰酸发生加成反应生成 ,则B是丙酮,1mol
,则B是丙酮,1mol  可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是苯酚,
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是苯酚, 发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,D的相对分子质量是100,则D的分子式为:C5H8O2,D的不饱和度=$\frac{2×5+2-8}{2}$,所以D中含有碳碳双键,且含有酯基,所以D的结构简式为:CH2=C(CH3)COOCH3,D发生加聚反应生成F;异丙烯酸和SOCl2发生取代反应生成G,G的结构简式为:CH2=C(CH3)COCl,G反应生成H,H反应生成
发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,D的相对分子质量是100,则D的分子式为:C5H8O2,D的不饱和度=$\frac{2×5+2-8}{2}$,所以D中含有碳碳双键,且含有酯基,所以D的结构简式为:CH2=C(CH3)COOCH3,D发生加聚反应生成F;异丙烯酸和SOCl2发生取代反应生成G,G的结构简式为:CH2=C(CH3)COCl,G反应生成H,H反应生成 ,则H是
,则H是 ,
,
(1)苯和丙烯发生加成反应生成异苯丙烷,所以①的反应类型为加成反应,通过以上分析知G的分子式为 C4H5OCl,故答案为:加成反应,C4H5OCl;
(2)A是苯酚,苯酚和溴水发生取代反应,反应方程式为 ,
,
故答案为: ;
;
(3)通过以上分析知,B的结构简式为: ,扑热息痛的结构简式为
,扑热息痛的结构简式为 ,
,
故答案为: ;
; ;
;
(4)D的结构简式为:CH2=C(CH3)COOCH3,D分子中的含氧官能团为酯基,故答案为:酯基;
(5)扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查了有机物的合成,明确有机物的官能团及其性质是解本题关键,采用正逆相结合的方法进行分析,难点是同分异构体种类的判断,注意有碳链异构、官能团异构和顺反异构,难度较大.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | $\frac{36.5a}{22.4(a+1)d}$ | B. | $\frac{1000ad}{36.5a+22.4}$ | ||
| C. | $\frac{ad}{36.5a+22400}$ | D. | $\frac{1000ad}{36.5a+22400}$ |
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 | |
| D. | 该反应每消耗3 mol X-,转移电子的物质的量为2 mol |
| A. | CH4+2 O2 $\stackrel{点燃}{→}$ CO2+2H2O | |
| B. | CH2=CH2+H2 $\stackrel{催化剂}{→}$ CH3-CH3 | |
| C. |  +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$ +HBr +HBr | |
| D. | 2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$ 2CH3CHO+2 H2O |

| A. | 铁片上发生氧化反应Fe-3e-═Fe3+ | B. | 铜片上发生还原反应2H++2e-═H2↑ | ||
| C. | 铜片上发生氧化反应Cu-2e-═Cu2+ | D. | 溶液中NO${\;}_{3}^{-}$的浓度基本不变 |
 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.(1)①该反应的化学平衡常数表达式是K=$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$.
②该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
③理论上,为了增大平衡时H2的转化率,可采取的措施是a、d.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:16:6:6.
| A. | 碳酸钙和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁粉和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向澄清石灰水中通入少量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| A. | Ba(OH)2溶液和稀H2SO4的反应 | B. | Cu(OH)2和稀H2SO4的反应 | ||
| C. | NaOH溶液和氢溴酸反应 | D. | NaOH溶液和醋酸溶液的反应 |