题目内容
16.已知水的电离方程式:H2O?H++OH-.下列叙述中,正确的是( )| A. | 向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变 | |
| B. | 降低温度,KW减小,pH不变 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低 |
分析 水的电离过程是吸热过程,升温促进水的电离,加入酸或碱抑制水的电离,加入能水解的盐能够促进水的电离,依据影响水电离的因素分析解答.
解答 解:A.向水中加入少量硫酸氢钠溶液,完全电离,溶液中氢离子浓度增大,水的离子积常数与温度有关,与离子浓度无关,所以温度不变,KW不变,故A正确;
B.水的电离方程式:H2O?H++OH-,KW=c(OH-)×c(H+),常温下,水的离子积常数为Kw=10-14,水的电离为吸热过程,降低温度,KW减小,氢离子浓度减小,pH=-lg〔H+〕,氢离子浓度越小,pH值越大,故B错误;
C.向水中加入氨水,氨水是弱碱,弱碱氨水电离出的氢氧根离子,对于H2O?H++OH-,平衡向逆反应方向移动,抑制水的电离,但氨水电离出的氢氧根离子比水平衡向右移动减少的氢氧根离子多,所以总体c(OH-)增大,故C错误;
D.NaClO为弱酸强碱盐,向水中加入NaClO固体,次氯酸根离子与水电离出的氢离子结合,生成弱电解质次氯酸,促进水的电离,平衡向正反应方向移动,氢离子浓度减小,氢氧根离子浓度增大,溶液显碱性,故D错误;
故选A.
点评 本题主要考查了水的电离的影响因素,解答的关键是理解平衡移动的原因,离子积常数随温度变化,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.已知硒元素的核电荷数为34,下列关于80Se的说法正确的是( )
| A. | 80Se的核外有34个电子 | B. | 80Se的质量数是46 | ||
| C. | 80Se的核内有34个中子 | D. | 80Se的核内有80个质子 |
7.砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,正确的是( )
| A. | 与H2化合的能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | AgAt易溶于水 | D. | 砹难溶于水,易溶于四氯化碳 |
5.下列物质熔点变化顺序中,不正确的是 ( )
| A. | NaF>NaCl>NaBr>Nal | B. | NaCl<MgC12<AlCl3>SiCl4 | ||
| C. | LiF>NaCl>KBr>Csl | D. | Al2O3>MgO>CaO>BaO |
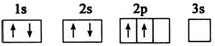
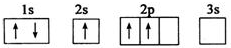
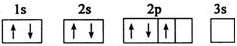
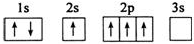
 现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题:
现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题: 钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
 ;
;